| TEMA | BIOQUIMICA DE LAS CARIES |
| TIEMPO APROXIMADO | 45 MINUTOS |
| AUDIENCIA | Alumnos CURSO CARIOLOGIA3er año, Odontología, U Mayor |
| INSTRUCTORES | Gabriela Bustos P. Alumna 3er año, Odontología, U Mayor. |
- I. Racional.
- II. Objetivos Terminales.
- III. Objetivos Específicos.
- Ciclo de Práctica I.
- Ciclo de Práctica II
- Ciclo de Práctica III
- Ciclo de Práctica IV
I. RACIONAL
La comprensión de la composición y formación desde el punto de vista bioquímico de la caries, permite al odontólogo tener una visión mas especifica del proceso de la caries, y los mecanismos moleculares que están involucrados y así, de esta forma, poder hacer mejor uso de los recursos odontológicos para su prevención y tratamiento.
II. OBJETIVOS TERMINALES
El alumno será capaz de tener conocimiento sobre la composición bioquímica del diente, sus etapas de formación y los distintos factores que pueden incidir en ella, relacionándolo con los factores que predisponen a la aparición de caries en el individuo y la evolución a nivel molecular de esta.
III. OBJETIVOS ESPECIFICOS
- El alumno estará capacitado para:
- Tener conocimiento sobre la composición molecular del esmalte y dentina.
- Poseer conocimiento de la formación del esmalte desde un punto de vista bioquímico, y como afecta en la predisposición a la caries.
- Adquirirá conocimientos de las propiedades bioquímicas de los tejidos que componen el diente y su implicancia en el proceso de la caries.
- Obtendrá conocimientos específicos sobre el desarrollo a nivel molecular de la caries en tejidos como el esmalte y la dentina.
- Logrará aplicar los conocimientos aprendidos en la prevención y tratamiento de la caries en pacientes.
CICLO DE PRACTICA I
ESMALTE
1. Amelogénesis:
Consta de varios pasos que incluyen las etapas secretoras, de transición y de maduración. Esta última son ciclos repetitivos donde los ameloblastos van cambiando su forma y se va produciendo la elongación de los cristales del esmalte.
En la etapa secretora, los ameloblastos que se ubican en forma de columna, adyacentes a la formación del esmalte, van a secretar la matriz de proteínas especializadas, en conjunto con los iones necesarios para que ocurra la precipitación y la formación de los cristales del esmalte, el cual al ir creciendo va corriendo a los ameloblastos hacia la periferia.
Las proteínas de largo completo se ubican en el frente de mineralización, sugiriendo que estas participan en la elongación de los cristales. También existen proteínas que se ubican además de en el frente, en los costados, dirigiendo el crecimiento ordenado de los cristales otorgándoles así, su forma característica.
Fig.1 Fotografía de microscopía electrónica de barrido, en donde se ve la forma de los cristales de hidroxiapatita, uno al lado del otro, en forma ordenada. Entre medio deberían ir las proteínas que dirigen su crecimiento ordenado. (Montoya M. Clases teóricas. Curso Cariología 2008, Fac. Odontología, U. Mayor.)
Una vez que los cristales ya se forman y como parte del proceso de formación del esmalte, está la degradación de este componente orgánico, es decir, las proteínas, y el relleno del espacio que dejan con cristales.
Entonces:
En la etapa secretora, se deposita casi el 100% de las proteínas y empieza la deposición del contenido mineral.
En la etapa de transición está la formación de la lámina basal.
En la etapa de maduración se empiezan a perder las proteínas y aumenta hasta el 100% el contenido mineral. Esto no significa que el esmalte sea 100% mineral, sino que del porcentaje mineral, en esta etapa se deposita el total. El componente proteico, la mayor parte es degradación de proteína, pequeños péptidos que van quedando entremedio y también a veces proteínas enteras. Esto es importante para después ver la formación de las caries en esmalte.
Después de la amelogenesis entonces, vemos los cristales ordenados y espacios entre ellos. El esmalte no es 100% sellado, posee microporos por donde pasan iones tales como protones de muy pequeño tamaño.
Durante los procesos en donde los ameloblastos sufren ciclos de modulación, los bordes quedan lisos sellándose completamente, sin permitir el intercambio de iones, quedando el pH cerca del fisiológico, o toman forma como bordes en cepillo, en donde hay un intercambio de iones con el medio externo, bajando el pH celular.
En un ciclo entonces comienza el depósito y el crecimiento de los cristales en forma exponencial. Durante la etapa de formación del cristal se van formando protones y los ameloblastos para compensar esa ganancia de protones o perdida de pH, recurre al sistema Bicarbonato, el cual a través de anhidrasas carbónicas especificas, toman los protones y los secretan en forma de bicarbonato hacia el medio. Esto es para tamponar el medio interno, ya que en concentraciones altas de protones se impide el crecimiento de los cristales.
Por esta situación de liberación de protones en algunos casos el carbonato es capaz de reemplazar a algunos fosfatos del cristal de hidroxiapatita, quedando este cristal más inestable, más soluble.
Otra situación que ocurre asociada a la formación de los cristales es la llegada de Sodio y Magnesio. El problema que esto conlleva es que el Sodio y el Magnesio son capaces de reemplazar al Calcio en los cristales de hidroxiapatita, haciéndolo más inestable, por ende mas soluble. Esto es importante en la formación de la Caries, ya que estos componentes son normales en la formación del esmalte, pudiendo alterar la calidad del esmalte, teniendo así zonas con diferente solubilidad de esmalte.
Se sigue hasta última hora en la etapa de maduración sintetizando proteínas nuevas, la función de estas proteínas no se conoce muy bien, pero van a formar parte del esmalte. Esto es importante, ya que aquellas zonas donde hay mayor contenido proteico, es más fácil la degradación en caso de haber caries, ya que estas zonas no son completamente selladas.
El ameloblasto va secretando iones para formar el precursor del cristal de hidroxiapatita, el que va poco a poco creciendo hasta formar el prisma de hidroxiapatita. Todo esto dirigido por las proteínas que tienen que degradarse en el momento adecuado. Entonces las proteasas logran el alineamiento y formación de la estructura, y se van degradando con el tiempo.
La calidad del esmalte que se forma finalmente, va a depender de cada persona.
El 80-90% de los cristales son de Hidroxiapatita de calcio carbonatado.
El 10-20% restante corresponde a fluidos y material orgánico, que quedan entremedio de los cristales.
2. Estructura:
Es uno de los tejidos más duros del organismo incluso más duro que los huesos, es acelular y está compuesto por una fase inorgánica (95%), que constituye los cristales de hidroxiapatita, estos cristales de OH apatita también se encuentran en dentina y cemento, pero en el esmalte son más grandes y largos con 50 nm de diámetro al corte transversal y 100 um de longitud.
El cristal de OH apatita esta constituido por estructuras repetidas de calcio, fosfatos e hidroxilos, cuya fórmula es (Ca10(PO4)6(OH)2), estos iones se alinean para formar cristales hexagonales, que a su vez se van a empaquetar densamente constituyendo un prisma o varilla del esmalte.
El otro 5% es la fase orgánica está constituido por agua y proteínas (amelogenina, ameloblastina, enamelina, etc), las cuales en el esmalte maduro pasan a ser residuos de proteínas que van quedando en el esmalte.
Esta es la composición general del esmalte, donde desde la superficie externa hasta la unión amelodentinaria la proporción de mineral es mayor en la parte externa que en la parte interna del esmalte. El componente orgánico, además, va aumentando hacia la unión amelodentinaria. Por eso mismo la densidad es distinta en sus diferentes porciones, siendo mayor hacia la capa externa que en la interna, por la existencia de mayor contenido orgánico en esta ultima y de fluidos.
La superficie del esmalte esta rodeado por una película que esta constituida por la absorción selectiva de proteínas desde la saliva a la superficie del esmalte, las cuales influyen en las propiedades físico químicas porque constituyen una barrera que impide la perdida de minerales y también la remineralización porque impide también la entrada hacia el esmalte.
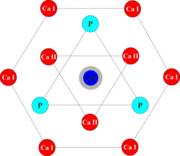
3. Cristal de OH apatita:
Constituido por un núcleo central que es el Hidroxilo con fosfatos distribuidos con una anulación de 60º unos de otros formando un triangulo alrededor del hidroxilo. Formando otro triangulo tenemos a los iones calcio que también van a estar orientados a 60º unos de otros. Y finalmente toda la estructura está rodeada por una red hexagonal constituida por iones calcio que le da la forma de hexágono a la OH apatita.
Fig.2. Estructura del cristal de hidroxiapatita
(http://dopamine.chem.umn.edu/chempedia/index.php/Toothpaste)
Fig.3. Microscopía electrónica de transmisión donde se observan los cristalitos del esmalte que están organizados y empaquetados. (Hernández M. Clases teóricas. Curso Cariología 2006, Fac. Odontología, U. Mayor.)
Entre los cristales y entre los prismas es donde se concentra la mayor cantidad de agua y sustancia orgánica, como también la menor concentración de iones.
Estos iones no se distribuyen en forma pareja, siendo más concentrados en la superficie y menos concentrado en la profundidad del esmalte, puntos y fisuras.
Retroalimentación:
- Nombre los componentes del esmalte y su distribución:
- Nombre iones que reemplazan a los componentes del cristal:
Referencias Bibliográficas:
- Montoya M. Clases teóricas. Curso Cariología 2008, Fac. Odontología, U. Mayor.
- T.A. Mitsiadis y T. Rahiotis. Parabellls between tooth development and repair: Conserved molecular mechanisms following carious and Dental injury. J Dent Res 83(12):896-902, 2004.
- J. Arends and J. Chiristoffersen. The Nature of Early Caries Lesions in Enamel. J Dent Res 65(1):2-11, January, 1986.
CICLO DE PRACTICA II
PROPIEDADES DEL ESMALTE
1. Propiedades Físicas.
Las propiedades físicas del esmalte van a estar dadas por los cristales de hidroxiapatita, por lo tanto sus propiedades deberían ser similares. Sin embargo como el esmalte esta constituido por cristales que no son tan perfectos y que tiene reemplazados algunos de sus iones, sus propiedades físicas son levemente menores a las del cristal de hidroxiapatita pura.
Color: La hidroxiapatita tiene un índice de refracción (IR) de 1.64 lo que le da un aspecto completamente transparente. En cambio el esmalte tiene un IR de 1.33 pero además esta rodeado de agua lo que la un aspecto diferente más translúcido.
Dureza: Se da por el grado de cohesividad entre los cristales, teniendo la hidroxiapatita una dureza de 430 HKN y el esmalte de 370 HKN.
Solubilidad: La de la hidroxiapatita es menor que la del esmalte. Siendo la de la hidroxiapatita 7.41 x 10-60. Es difícil establecer cual es la solubilidad del esmalte, porque no es siempre la misma, esta determinado por diferentes factores como el lugar del diente que se trate, la presencia de ciertos iones y además porque la solubilidad esta dada a un pH y temperatura dados.
2. Solubilidad y disolución de la Hidroxiapatita (OHA):
![]() Ca3 (PO4)3 (OH) 5Ca 2+ + 3PO43- + OH
Ca3 (PO4)3 (OH) 5Ca 2+ + 3PO43- + OH
En soluciones acuosas las sales tienden a disolverse debido a la constante dieléctrica del agua. El agua tiende entonces a hacer que se liberen iones de la red y tiende a rodearlos e hidratarlos. Si nosotros colocamos OH apatita en agua va a tender a solubilizarse y va a liberar 5 iones de calcio, 3 fosfatos y un hidroxilo. Inicialmente la liberación de estos iones va a ser rápida pero llega un punto en que hay un equilibrio donde la disolución se define y hay un cambio mutuo entre los iones de la solución y el cristal.
Cuando hablamos de equilibrio significa que la solución esta saturada para este cristal, es ese caso el Producto de solubilidad (KSP) va a ser igual al de la actividad iónica (IAP) de la hidroxiapatita que es la que tiende a mantener al cristal integro y el KSP disolverlo.
Por lo tanto si:
- KSP es mayor a IAP es una solución insaturada, y por lo tanto va a haber una disolución de los cristales de hidroxiapatita
- KSP es menor a IAP la solución esta sobresaturada y va atender una precipitación y reformación de los cristales.
Además el grado de solubilidad esta determinado por otros 2 factores:
Temperatura:
Si consideramos una sal como el cloruro de sodio por ejemplo, cuando aumentamos la temperatura tiende a ser más soluble, pero con la OHA es todo lo contrario, cuando disminuye la temperatura aumenta la solubilidad. O sea al tomar una bebida caliente hay menos posibilidad de disolución del esmalte que una bebida fría.
pH:
El cloruro de sodio no es muy influenciable con los cambios de pH, pero para la OHA es crítico. Cuando hay una solución saturada, al bajar el pH iones hidroxilos y fosfatos van a tender a formar ácidos en presencia de los protones perdiéndose iones fosfatos e hidroxilos quedando la solución subsaturada respecto al cristal, esto va a provocar una disolución del cristal a la solución. Por lo tanto la baja de pH promueve la salida de iones.
Existe también el pH critico, que es cuando una solución que esta sobresaturada, se convierte en saturada, y por lo tanto es el punto limite donde la solución si baja un poco de pH se encuentre subsaturada y comience a disolver el cristal.
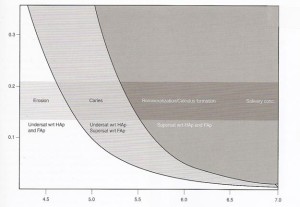
En la Fig.1 esta de nuevo otra explicación de cómo el pH actúa en la disolución de la OHA, la cual a pH ácido o cuando baja el pH se disuelve porque las soluciones que lo rodean se vuelven insaturadas (saliva, fluido de la placa bacteriana, etc.)
La disolución va a depender entonces del grado de instauración, o sea mientras más bajo el pH más disolución de la OHA.
Fig.1 Grafico solubilidad v/s pH. Se observa el pH que varia de 4 a 8 ya que el fisiológico va hasta los 7.4. Como vemos hasta el pH 5.5 la solubilidad es nula incluso hay una tendencia a la precipitación, pero del %. En adelante vemos como asciende la solubilidad de la OHA, por lo tanto el pH critico en función de la OHA esta en 5.5. (Tomado de Fejerskov O.,Kidd EAM. Dental Caries. Ed. Blackwell. 2003. Ch.4, p.57)
Si adicionamos cualquier ion va atender a disminuir la solubilidad o detenerla, o sea no necesitamos agregar los tres iones, basta q agreguemos o calcio o hidroxilo o fosfatos para poder detener.
3. Precipitación de la OH apatita:
Cuando la solución esta sobresaturada tenemos el fenómeno de la precipitación y además los cristales más pequeños o más mal formados van a tender a crecer, por lo tanto hay una recuperación de zonas donde había iones perdidos (carbonato o magnesio) y en general va a haber mayor estabilidad.
¿Cómo podemos sobresaturar la solución?
- una forma obvia es agregar los iones que componen el esmalte, entonces agregamos calcio y fósforo.
- Si elevo el pH se van a liberar esos iones que estaban formando ácido, entonces la solución va a quedar sobresaturada.
Pero este proceso de precipitación no es definido y no ocurre tanto porque hay efectos inhibidores como la saliva actúa como buffer y por otro lado evita la precipitación de sales de calcio por ejemplo en la salida de conductos. Dentro de estos inhibidores destacan algunas proteínas como albúmina y pirofosfatos. Además el cristal no puede crecer eternamente. Tiene restricciones inherentes, ya que dentro del tejido dentario solo va a crecer un par de manómetros en esmalte y dentina donde es más pequeña aun. También tiene restricciones físicas, ya que están tan estrechamente empaquetados los cristales que es imposible que haya espacio suficiente para que sigan creciendo, solo lo hacen en relación al espacio que hay.
4. Estabilidad de la OHA:
Hay varios fosfatos de calcio formando los tejidos mineralizados en estructuras orgánicas. Sin embargo al pH en que ocurren en la boca (normal) la OHA es lejos la estructura más estable.
Fig.2.Grafico que muestra que el pH que oscila entre 3 y 8 y acá la concentración de calcio requerida. Entonces vemos que a pH normal la OHA de calcio es la más estable de todas porque requiere una menor concentración de calcio en saliva para mantenerse estable.(Fejerskov O, Kidd EAM. Dental Caries. Ed. Blackwell. 2003. Ch.4, p.53)
Otros cristales como fosfato tricalcico, fosfato octocalcico y brushita son mas inestables porque necesitan mas calcio para mantenerse en estado sobresaturado. Esto ocurre a pH sobre 4.3 que supera con creces el pH normal de la boca, que es lo que ocurriría al tomar bebidas muy ácidas, entonces a menor pH de 4.3 otros cristales son mas estables que la OHA, pero no es lo que ocurre a condiciones fisiológicas.
5. Sustituciones en el esmalte:
Como sabemos hay iones extraños que sustituyen otros iones alterando las propiedades del esmalte. Entonces podemos decir que la OHA es una fluorapatita carbonatada porque hay un reemplazo del hidroxilo por fluor y fosfatos por carbonatos. Estos iones extraños alteran la solubilidad, el carbonato y el magnesio tienen un efecto sinérgico provocando un aumento de la solubilidad, por lo tanto tienen un efecto perjudicial, en cambio el fluor va a provocar una disminución de la solubilidad.
6. Fluidos orales:
En general, en condiciones fisiológicas, para la OHA están sobresaturadas. En el caso de la saliva no hay tendencia a estar precipitando constantemente cristales por el efecto inhibitorio de las proteínas salivales.
En cuanto al biofilm bacteriano esta más sobresaturado que la saliva, 2 a 4 veces más y por lo tanto favorece la remineralización y va a tender a calcificarse la placa bacteriana dando origen a la formación de cálculos, todo esto ocurre para la OHA en relación a un pH critico que como sabemos es 5.5.
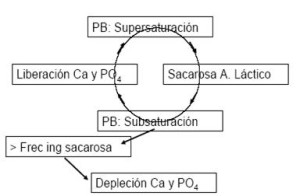
Con esto podríamos pensar que la placa bacteriana es buena, sin embargo esta posee una actividad metabólica, entonces al consumir azúcar, metaboliza la sacarosa originado Ácido láctico el cual baja el pH del fluido produciendo una subsaturación y haciendo que salgan iones del esmalte. (Fig.1)
La placa bacteriana a su vez es un reservorio de calcio y fosfato, cuando ocurre una disolución se va a liberar iones de la placa devolviendo los iones perdidos y la sobresaturación del fluido.
Fig.3. Ciclo de la actividad de la placa bacteriana. (Hernández M. Clases teóricas. Curso Cariología 2006, Fac. Odontología, U. Mayor.)
Estos son ciclos de baja de pH, subsaturación, disolución, aumento de pH y precipitación. Si nosotros tuviéramos una ingesta grosera de azúcar tendríamos este ciclo y no habría problema. Sin embargo si tenemos ciclos repetidos de ingesta de sacarosa va a llegar un momento en que el calcio y el fosfato que están en la placa bacteriana se agotan y en el momento en que se produce la subsaturación no se pueden reponer estos iones, entonces el esmalte se disuelve y se forma caries. Por lo tanto tiene más riesgo cariogénico la ingesta repetida de azúcar que la cantidad consumida en un solo momento.
Fig.4. Gráfico con los grados de saturación del medio salival, con los diferentes rangos de secreción salival. (O. Fejerskov y E.A.M. Kidd. Dental Caries. Ed. Blackwell. 2003. Ch.4, p.53)
En la Fig.4 vemos que la OHA y la fluorapatita están en un grado de sobresaturación, que va a ser mayor cuando hay una mayor secreción salival. Sin embargo la fluorapatita va a estar un poco más sobresaturada que la OHA. El fluoruro de calcio se encuentra subsaturado.
Retroalimentación:
- ¿Cuál es la dureza del esmalte y de la OHA?
- ¿Cuál es el pH crítico?
Referencias Bibliograficas:
- Montoya M. Clases teóricas. Curso Cariología 2008, Fac. Odontología, U. Mayor.
- J.M. Ten Cate. In situ models, Physico-chemical aspects. Adv Dent Res 8(2): 125-133, July, 1994.
- Markku Larmas. Odontoblast function seen as the response of dentinal tissue to dental caries. Adv. Dent. Res. 15:68-71, August, 2001.
CICLO DE PRACTICA III
CARIES
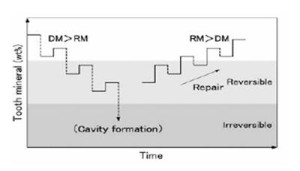
1. Desmineralización – Remineralización
La caries es un proceso que se puede ver desde un punto de vista exclusivamente químico, porque es un balance de la desmineralización v/s la remineralización del esmalte. Si la desmineralización es mayor que la remineralización, tenemos un proceso de caries, en el cual los cristales se van perdiendo hasta formar una cavidad. Si logramos tener una remineralización mayor y mas rápida que la desmineralización, se logra reparar el tejido y revertir el proceso de la formación de caries en el esmalte.
Entonces, estos dos procesos de desmineralización y remineralización están en un balance continuo, producto de los diferentes estímulos a los que está sometida la cavidad oral.
Fig.1. Ecuación de formación de la Hidroxiapatita. Tenemos Calcio, Fosfato, agua y protones que salen (Tomado de Oral Diseases (2004), 10:249)
En cualquier ecuación si uno coloca más producto, la ecuación se va a inclinar hacia los sustratos. Y si pongo más sustrato, la ecuación se va a ir hacia los productos.
A medida que hay más protones, la reacción se va a ir hacia los sustratos, es decir hacia los componentes solubles, hay disolución de los cristales.
Además, se pueden formar muchos distintos cristales y estos se están formando y disolviendo y no todos son iguales en calidad o insolubilidad que pueden llegar a ser. Entonces muchos de los cristales que están entremedio no son hidroxiapatita sino una combinación de varios tipos diferentes de cristales. Esta situación esta ocurriendo constantemente en la superficie del esmalte.
Debemos considerar que cada baja de pH en un punto va a provocar el aumento de la solubilidad de apatita multiplicado por 10.
Cuando hablamos de caries estamos hablando de la disolución del esmalte, pero la causa es producida por ácidos orgánicos productos del metabolismo de azucares de bajo peso molecular por la placa bacteriana
Pero cuando hablamos de erosión también es la disolución del esmalte pero por ácidos de otro origen, de cualquiera menos de la placa bacteriana, como por ejemplo el grabado ácido.
2. Caries
Cuando llegamos al pH crítico, o bajamos del pH crítico, ocurren dos situaciones:
- La OHA esta subsaturada
- La Fluorapatita esta sobresaturada porque es menos soluble
La subsaturación de la OHA va a provocar la disolución del esmalte subsuperficial constituyendo el cuerpo de la lesión que presenta una pérdida de mineral del 30-50%.
Pero como la fluorapatita esta sobresaturada, los niveles que se disuelven de la profundidad van a provocar un aumento o supersaturación a nivel de los fluidos provocando una precipitación de fluorapatita en la superficie del diente, pero no es capaz de ingresar más profundo. Entonces se esta perdiendo OHA desde el fondo de la lesión pero como la fluorapatita esta sobresaturada va a precipitar quedando atacado solo en la superficie de la lesión.
El efecto de esta capa superficial es ambivalente, por una parte protege el cuerpo de la lesión que ha perdido mineral porque actúa como barrera y por esto mismo va a impedir el ingreso de minerales como la fluorapatita hacia el interior del diente impidiendo la remineralización.
3. Remineralización:
Para que ocurra la remineralización se requiere de restos de cristales de OHA, se necesita de un esqueleto de cristal para volver a remineralizar. Como ya hemos visto también la solución debe estar supersaturada. Se necesita así mismo un control de la PB para que esta no este provocando una baja de pH.
Va a ocurrir siempre al interior de la capa superficial del esmalte o la mayor remineralización. Raramente en el cuerpo de la lesión porque la capa superficial actúa como barrera y también porque en el cuerpo de la lesión hay una perdida total de minerales, y no hay restos para remineralizarlos.
Se cree que cuando hay pérdida de la capa superficial, la fluorapatita si pasa al cuerpo de la lesión, sin embargo en términos terapéuticos no se recomienda sacar la capa superficial porque también quedan expuestos no solo a la fluorapatita, sino también a ácidos.
En la fig.2 se observa que donde hay una instauración de OHA y de fluorapatita a pH muy bajos. Las caries por una baja de pH al critico hay una subsaturación de la OHA pero una sobresaturación de la fluorapatita lo que determina la formación de una capa superficial. Y cuando tenemos remineralización se encuentra sobre el pH crítico.
Fig.2. Condiciones de erosión. (O. Fejerskov y E.A.M. Kidd. Dental Caries. Ed. Blackwell. 2003. Ch.4, p.53)
Retroalimentación:
- ¿Qué debe ocurrir entre la desmineralización y remineralización para que exista caries?
- ¿Para qué son necesarios los restos de cristales de hidroxiapatita?
Referencias Bibliográficas:
- Montoya M. Clases teóricas. Curso Cariología 2008, Fac. Odontología, U. Mayor.
- J.M. Ten Cate. In situ models, Physico-chemical aspects. Adv Dent Res 8(2): 125-133, July, 1994.
- Markku Larmas. Odontoblast function seen as the response of dentinal tissue to dental caries. Adv. Dent. Res. 15:68-71, August, 2001.
CICLO DE PRACTICA IV
DENTINA
1. Dentina.
La dentina está regida por las mismas reglas que el esmalte del punto de vista químico. Pero hay factores que considerar.
Tiene un 75% de mineral con una OHA más pequeña, con un diámetro de 3 a 30nm y 50um de longitud. Por lo tanto tiene una mayor superficie expuesta para intercambiar iones.
Tiene un 25% de materia orgánica y agua constituido principalmente por colageno tipo I y proteínas no colágenas como glicoproteínas, glucoproteínas, fosfolípidos, proteoglicanos, fosfoproteínas, etc.
Estas proteínas constituyen una red importante para mantener a la OHA en posición, de manera que componente orgánico, principalmente el colágeno en la dentina tiene un efecto sinérgico con la OHA. El colágeno mantiene a la OHA en posición y a su vez no se requiere solamente de disolución del cristal, va a haber una perdida de material orgánico para lo que se requiere proteinasa, estas proteasas no tiene acceso a la red de colágeno si la OHA esta en posición, por lo tanto se protegen mutuamente.
Adema hay que considerar la presencia del complejo pulpodentinario donde este puede responder porque es vital, lo que hace es ir colocando más mineral en el interior del túbulo obliterándolo a veces. Y por otro lado existe un fluido en los tubulos dentinarios, donde hay una gradiente de presión que va dirigido hacia la superficie de la dentina y esmalte, por lo tanto los iones (protones) tendrían que superar esta gradiente de presión para introducirse a la dentina.
2. Caries dentinaria:
Cuando la dentina se expone a la cavidad oral por retracción gingival o por otros factores, vamos a tener reordenamiento del mineral y una mayor susceptibilidad a las caries porque la OHA es más imperfecta. Esto se comprueba en pacientes con hiposialia que en esmalte no tienen caries, pero en la superficie dentinaria expuesta si.
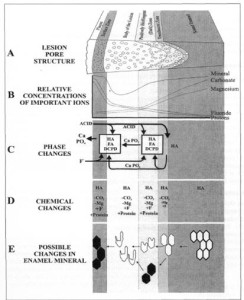
3. Zonas de la Lesión.
La primera zona, es donde está el frente de avance de la lesión y se llama zona traslucida. En esta zona hay una pérdida de mineral que va de un 1-2%. Está compuesto por un pequeño número de poros pero de bastante longitud. Estos poros son los microporos por los cuales se desplazaban los protones entre medio de los cristales, los cuales ahora al ir pasando van desmineralizándolos y por lo tanto ampliándolos en longitud y diámetro.
Zona oscura o birrefringente. En esta zona la porosidad aumenta entre un 5 a 10%, pero aquí tenemos poros largos y poros pequeños. Los poros son más pequeños porque hay depósito de material orgánico y proteínas en ellos.
Zona del Cuerpo de la Lesión, donde está la mayor pérdida de material inorgánico. Existe un 25 a 50% de porosidad, por lo cual prácticamente los cristales de hidroxiapatita están siendo degradados por todas partes. Los poros se agrandan hasta que hay destrucción mecánica del diente o cavidad de la caries.
Zona superficial, es la que esta en contacto con la placa. Esta es una superficie relativamente intacta, existiendo una porosidad entre 1 a 2%. Existen distintas hipótesis acerca del motivo por el cual esta zona esta prácticamente intacta, siendo la más aceptada hoy en día la que postula que en esta zona se produce una remineralización de los cristales producto de todos los iones que se están solubilizando en las zonas mas profundas, los que ejercen presión, en conjunto con los productos de la placa bacteriana y constituyentes de la saliva.
Fig. 1. Se observa en (A) las zonas de la lesión, en (B) concentraciones relativas de iones importantes, en (D) los cambios de iones que ocurren en distintas zonas de la lesión y en (E) los cambios que le ocurren a los cristales. (Crit Rev Oral Biol Med (2000), 11:481)
En cuanto a la concentración de iones (fig.1), esta es importante porque refleja el motivo por el cual se forma la zona superficial, es que por ejemplo la cantidad de fluoruros en la superficie es mucho más elevada que hacia la dentina.
Los iones como el carbonato y el magnesio, que desestabilizaban los cristales de apatita están en baja concentración en la superficie, y alta hacia el limite amelodentinario, y que son mucho más solubles que los de hidroxiapatita, comprobándose que son aquellos que se disuelven en los procesos cariosos.
4. Proteínas de la saliva
También son importantes las proteínas de la placa que se encuentran en contacto con la superficie del esmalte, ya que es la capa en más directa relación con la zona superficial del esmalte, y es ella la principal responsable de lo que ocurre en el esmalte. Esta presenta una barrera semipermeable bastante importante en la desmineralización y remineralización del esmalte.
Fig.2. Cuadro con las principales funciones de la saliva, que son importantes porque estas proteínas de la saliva son las que van a formar la placa bacteriana. (Caries Res (2004), 38:247)
Dentro de las funciones de la saliva, hay que destacar las que tienen que ver con los procesos de remineralización y con las inhibidoras de la desmineralización. También son importantes aquellas antibacterianas, antifungicas y antivirales, ya que son estos microorganismos los que durante su metabolismo van a generar gran parte del ácido que va a estar en contacto con el esmalte.
Dentro de las antibacterianas, las inmunoglobulinas previenen la adhesión de las bacterias al esmalte. Las mucinas inhiben la desmineralización, las proteínas ricas en prolina, el fosfato de calcio, importante en la remineralización, etc. Estas y otras proteínas del esmalte se verán en el cuadro a continuación.
En la medida en que tengamos proteínas que sean capaces de captar distintos iones y mantenerlos en el esmalte, vamos a estar favoreciendo la remineralización del esmalte.
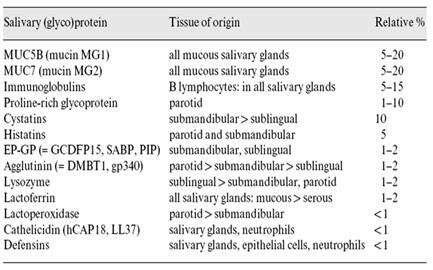
Fig.3. Tabla de las concentraciones relativas de algunas proteínas en la saliva. Hay muchas proteínas que son importantes y que su concentración esta por sobre el 5% en la saliva. (Caries Res (2004), 38:247)
Existe un estudio reciente, hecho el año 2006, donde a través de mediciones por electroforesis (bidimensional), se separan las proteínas por distintas características, en este caso, por peso molecular y punto isoeléctrico (fig.4). En este estudio se tomaron tres tipos de muestras. La primera era una muestra de saliva completa para comparar si hay diferencia respecto a la susceptibilidad a la caries, en personas libres de caries y en personas susceptibles a caries.
Fig.4. Electroforesis bidimensional. (Eur J Oral Sci (2006), 114:147)
El resultado de esta muestra dio que no hay grandes diferencias significativas en la composición de las proteínas de la saliva. La segunda muestra fue de la placa bacteriana de los dos grupos en cuestión, cuya extracción se realizo con un compuesto llamado guanidina, por eso el nombre HAPG, donde se saca casi toda la película en contacto con el esmalte. Los resultados tampoco arrojaron cifras significativas, aunque la diferencia era mayor que en el anterior. Luego se hizo una segunda extracción de la placa bacteriana pero esta vez utilizando un compuesto llamado Ácido Trifluoracetico, el cual es muy fuerte, y desprendió toda la placa bacteriana incluyendo aquella más fuertemente adherida al esmalte. Aquí es donde se encontraron las grandes diferencias entre los pacientes libres de caries y los susceptibles a caries, ya que en estos últimos aquellas proteínas que son las primeras en formar la placa, es decir, aquellas que se unen mas íntimamente con los cristales de hidroxiapatita, se encontraron Igs, lactoferrinas y amilasas. En aquellas personas que no presentan caries se encuentran más abundantemente proteínas ricas en prolina, catesinas, cistatinas, lipocalinas,etc. En general son proteínas que poseen carga negativa, por ende que se fosforilan y se unen firmemente al cristal que también tiene fosfato y calcio, y esta fuerte unión es necesaria para el proceso de remineralización del esmalte. Al ser proteínas cargadas impiden el movimiento de iones hacia la saliva de lo que se esta desmineralizando, manteniendo una alta concentración de iones en el esmalte.
Fig.5. Resultados del estudio hecho con electroforesis bidimensional. Las proteínas subrayadas con rojo son las que se encontraron presentes en las personas libres de caries (CF) (Eur J Oral Sci (2006), 114:147)
Retroalimentación:
- Nombre las zonas de la lesión de la caries:
- ¿Por qué son importantes las proteínas de la saliva en los procesos de remineralización y desmineralización de esmalte?
Referencias Bibliográficas:
- Montoya M. Clases teóricas. Curso Çariología 2008, Fac. Odontología, U. Mayor.
- C.Robinson, R.C. Shore, S.J. Brookers, S. Strafford, S.R. Wood, J. Kirkham. The chemistry of enamel caries. Crit. Rev. Oral Biol. Med. 11(4):481-495 (2000).
- J.M. Ten Cate. In situ models, Physico-chemical aspects. Adv Dent Res 8(2): 125-133, July, 1994.
- Markku Larmas. Odontoblast function seen as the response of dentinal tissue to dental caries. Adv. Dent. Res. 15:68-71, August, 2001.