UNIVERSIDAD MAYOR
FACULTAD DE ODONTOLOGIA
UNIDADES DE AUTO - APRENDIZAJE
| TOPICO |
REPARACION |
| TIEMPO APROXIMADO |
45 MINUTOS |
| AUDIENCIA |
Alumnos curso de
Patología General,
2º año, Fac. Odontología, U Mayor |
| INSTRUCTOR |
Dr. Benjamín
Martínez R. |
I. RACIONAL:
¿Qué sucedería si
después
de extraer una pieza dentaria, los tejidos no se repararan?. Esta
pregunta
basta para señalar la importancia de la reparación en
boca.
II. OBJETIVOS
TERMINALES:
El alumno podrá describir las
características
de la regeneración y cicatrización en diferentes tejidos,
y sus variedades.
III.
OBJETIVOS
ESPECIFICOS:
El alumno estará capacitado para:
-
describir los diferentes tipos de
células
importantes en la reparación.
-
describir las características
del tejido
de granulación.
-
señalar los factores que
afectan la
reparación.
-
describir la reparación por
primera
y segunda intención.
-
describir la reparación en
epitelio,
músculo, fibras nerviosas, hueso y alvéolo
post-extracción.
CICLO DE PRACTICA I
Generalidades
Siempre que tenemos en un tejido una
inflamación,
ésta persigue restituirlo de la mejor manera y como estaba antes
de la acción de la injuria. A veces es posible que sea
reemplazado
el tejido de forma completamente similar a como está antes, y
esto
se denomina regeneración. Otras veces se debe reemplazar por
tejido
fibroso y se forma una cicatriz, y este proceso se llama
cicatrización.
En general, la regeneración,
significa
un reemplazo del tejido lesionado por tejidos que cumplan la misma
función.
Esta capacidad es variable, para diferentes tipos de células y
también
en diferentes especies animales (por ejemplo, una lombriz, si se parte
en dos, da orígen a dos lombrices). En el hombre esta capacidad
está limitada. Las células lábiles tienen una vida
corta y se multiplican constantemente como en los epitelios de
revestimiento,
y las células de la médula ósea
hematopoyética.
Otras células tienen poca capacidad de multiplicarse, como los
hepatocitos,
células del páncreas y túbulos renales, y se
conocen
como células estables. Otras no tienen ninguna capacidad de
multiplicarse,
como las neuronas, y son células permanentes.
La capacidad de las células para
empezar a multiplicarse y regenerar un tejido se debería a dos
factores:
al aumento de RNA en forma local, debido a la muerte celular que se ha
producido, que deja este RNA libre y serviría como base para la
nueva síntesis de DNA. Y también que debido a la muerte
celular
se pierden las chalonas o se estimulan factores de crecimiento, las
células
vecinas tratarían de formarlas para suplirlas. Las chalonas son
proteínas, hoy conocidas como factores de crecimiento, que
están
en las membranas celulares e inhiben las mitosis, cuando están
en
condiciones normales. Además el crecimiento celular es
estimulado
por la formación de diversos factores de crecimiento, que en
distintos
tejidos se pueden formar ante diversos estímulos, tales como el
factor de crecimiento epidérmico, factor de angiogénesis,
etc.
Para entender el proceso de la
reparación
(término con el que incluímos tanto la
regeneración
como la cicatrización), veamos lo que ocurre al hacerse una
herida
en la piel. Primero hay hemorragia que formará un
coágulo,
en éste a través de la malla de fibrina llegan los
leucocitos
para fagocitar los detritos y en el tejido vecino se observarán
signos histológicos propios de una inflamación aguda. Con
los días, el coágulo se reseca y forma una costra que
protege
el tejido. Mientras tanto los macrófagos y PMN han eliminado
detritos
y empiezan a eliminar la costra; simultáneamente han aparecido
numerosos
brotes de capilares desde los vasos sanguíneos
periféricos
(estimulados por el factor de angiogénesis, producido por los
macrófagos),
que sangran fácilmente, probablemente por estar
constituídos
por paredes delgadas (una célula endotelial). También en
este tejido, que ahora llamamos tejido de granulación, por su
aspecto
granuloso dado por los brotes de capilares, aparecen fibrobastos que
inician
la formación de colágeno y sustancia fundamental, que a
medida
que aumentan provocan el remodelamiento vascular y estrechamiento de
sus
lúmenes. El proceso significa un reemplazo del coágulo
por
este tejido de granulación, a esto suele denominársele
organización.
Hoy en día se han demostrado
diferentes
factores de crecimiento importantes en la reparación de
distintos
tejidos, en la referencia de Martin, 1997, encuentra una buen
actualización.
Referencias Bibliográ;ficas
-
Wilhelm, D.L. : Inflammation and
healing in
Anderson, W.A.D. and Kissane, J.M. Pathology. 7th Ed. Mosby St. Louis,
1977. Chap. 2 pag. 76-80.
-
Holland, P.D.J. : Inflammation,
Regeneration
and Repair in B. Cohen and I.R.H. Kramer. Scientific Foundations of
Dentistry.
Year book Med. Pub. Chicago 1976. Chap. 8, pag. 116-121.
-
Martin P. Wound healing-aiming for
perfect
skin regeneration. Science 276:75-81, 1997.
-
Aukhil I. Biology of wound healing.
Periodontology
2000, 22:44-50, 2000
Retroalimentación
1) Según su capacidad de
regenerar
las células se clasifican en (dé un ejenmplo de cada uno):
a).............. ejemplo:
b).............. ejemplo:
c).............. ejemplo:
2) Las principales
características
morfológicas del tejido de granulación son:
3) Defina factores de crecimiento.
Nombre
tres e indique sus funciones.
CICLO DE PRACTICA II
Tipos de Cicatrización
La cicatrización puede ser de dos
variedades
de acuerdo, especialmente, a la cercanía de los extremos. Entre
más cerca, como que se están contactando borde con borde,
por ejemplo, después de haber suturado en una
intervención
quirúrgica, se produce una reparación por primera
intención.
En ciertas ocasiones hay gran pérdida de tejidos, los bordes
quedan
muy distantes, y en este caso tenemos la raparación por segunda
intención.
En el primer caso hay poca
destrucción
de tejido y prácticamente ha habido pérdida
exclusivamente
de epitelio y de pequeñas zonas del corion, o dermis papilar en
el caso de tratarse de heridas de piel. También puede ser la
incisión
de un cirujano, en que al suturar deja todos los planos unidos entre
sí:
músculo con músculo, tejido adiposo con tejido adiposo,
etc.,
lo cual producirá una regeneración de dichos tejidos.
En la reparación por segunda
intención
ha habido gran destrucción de tejido y el tejido de
granulación
que se forma es reemplazado lentamente por tejido fibroso, que
persistirá
como cicatriz.
La reparación además,
depende
de otros factores generales y locales. Entre los primeros: la edad, se
dice que es mejor la reparación en jóvenes que en
ancianos;
la nutrición, en especial se conoce que la falta de vitamina C
produce
falla en el colágeno; alteraciones hematológicas, como la
agranulocitosis, fallas de la coagulación; inmunodeficiencias
impiden
o retardan la regeneración, enfermedades sistémicas tales
como diabetes, etc. Otros factores como hormonales, como el exceso de
estrógeno
pueden producir reacciones exageradas.
Los factores locales más
importantes
son: aporte sanguíneo se sabe que en enfermedades vasculares
localizadas
la reparación es más lenta (por ejemplo, un paciente con
várices en la pierna, que presenta una úlcera, en la
misma
zona); el movimiento, entre mayor sea éste, peor es la
reparación;
igualmente la falta de coaptación de los bordes, y la presencia
de cuerpos extraños o infección en la herida
retardarán
su reparación.
Fibrosis
y calcificación de válvula.
Fig. 1. Fibrosis y
Calcificación de
válvula: http://155.37.5.42/eAtlas/CV/649.htm
Referencias Bibliográficas
-
Robbins, S.L. : Patología
Estructural
y funcional Ed. Interamericana, 1975 México, Págs. 98-191.
Retroalimentación
1.- ¿Qué lesión
vascular
afecta la reparación?
a. várices
b. arterioesclerosis
c. diabetes
d. todas las anteriores
2.- ¿Cuándo se produce
una
reparación por segunda intención?
3.- ¿Qué diferencias
existe
entre reparación por primera y segunda intención?
CICLO DE PRACTICA III
Reparación en diferentes tejidos
Regeneración epitelial
El epitelio en la piel, se genera en
una
herida quirúrgica aséptica rápidamente: en 48
horas
cubre toda la herida; posteriormente continúa un proceso de
engrosamiento
de la epidermis. Para que esto se efectúe las células
basales
epiteliales deben migrar, proliferar y diferenciarse. La capacidad de
migrar
se debe al citoesqueleto, contracción de los filamentos
citoplasmáticos,
especialmente de actina. En cuanto a proliferar, se cree que el
estímulo
sea dado por las chalonas, hoy en día conocido como factores de
crecimiento epidérmico. También podrían actuar
mecanismos
de inhibición por contacto en el cual cuando las células
de cada lado llegan a contactarse terminan de multiplicarse, y lo
empezarían
cuando no están en contacto.
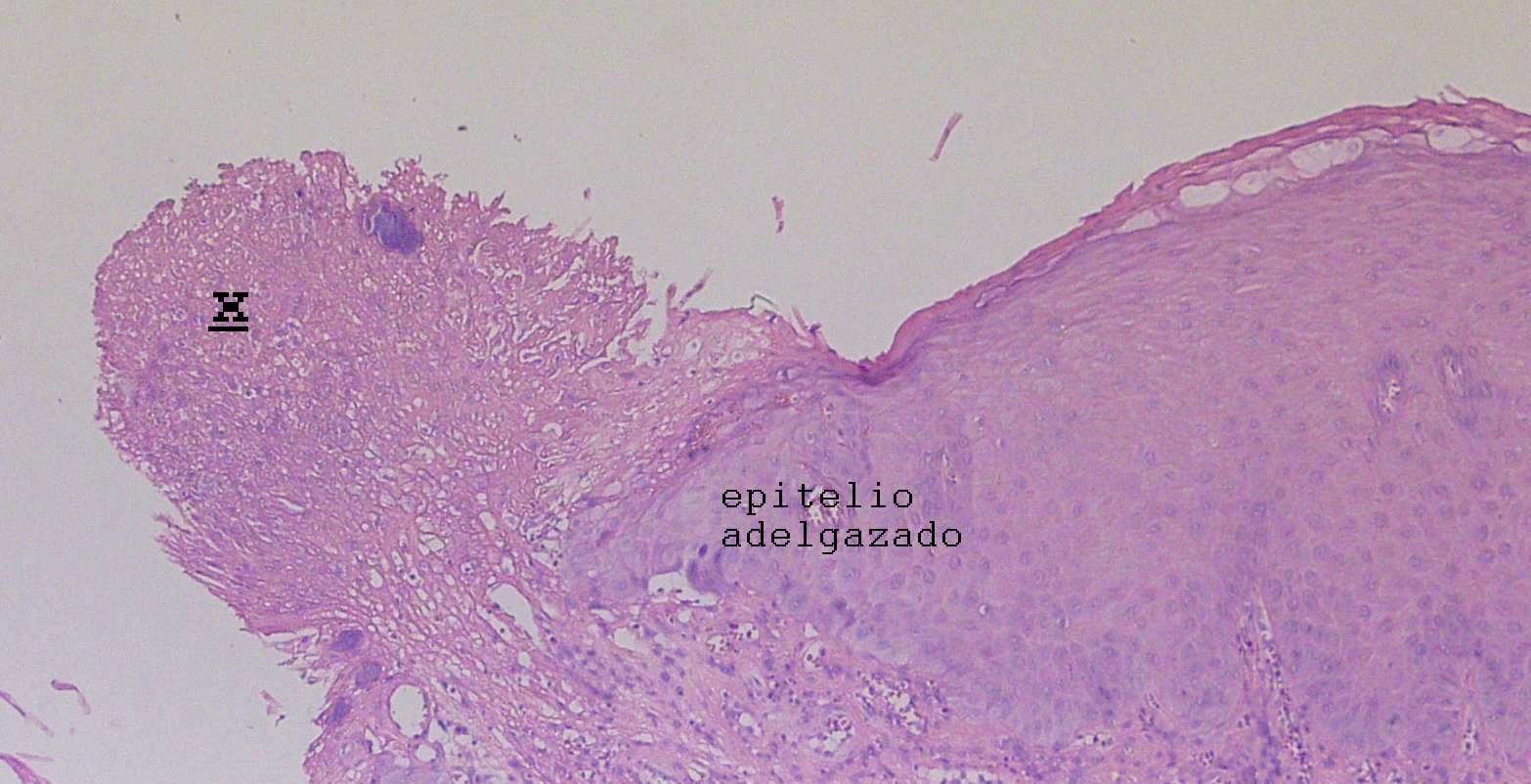 a
a 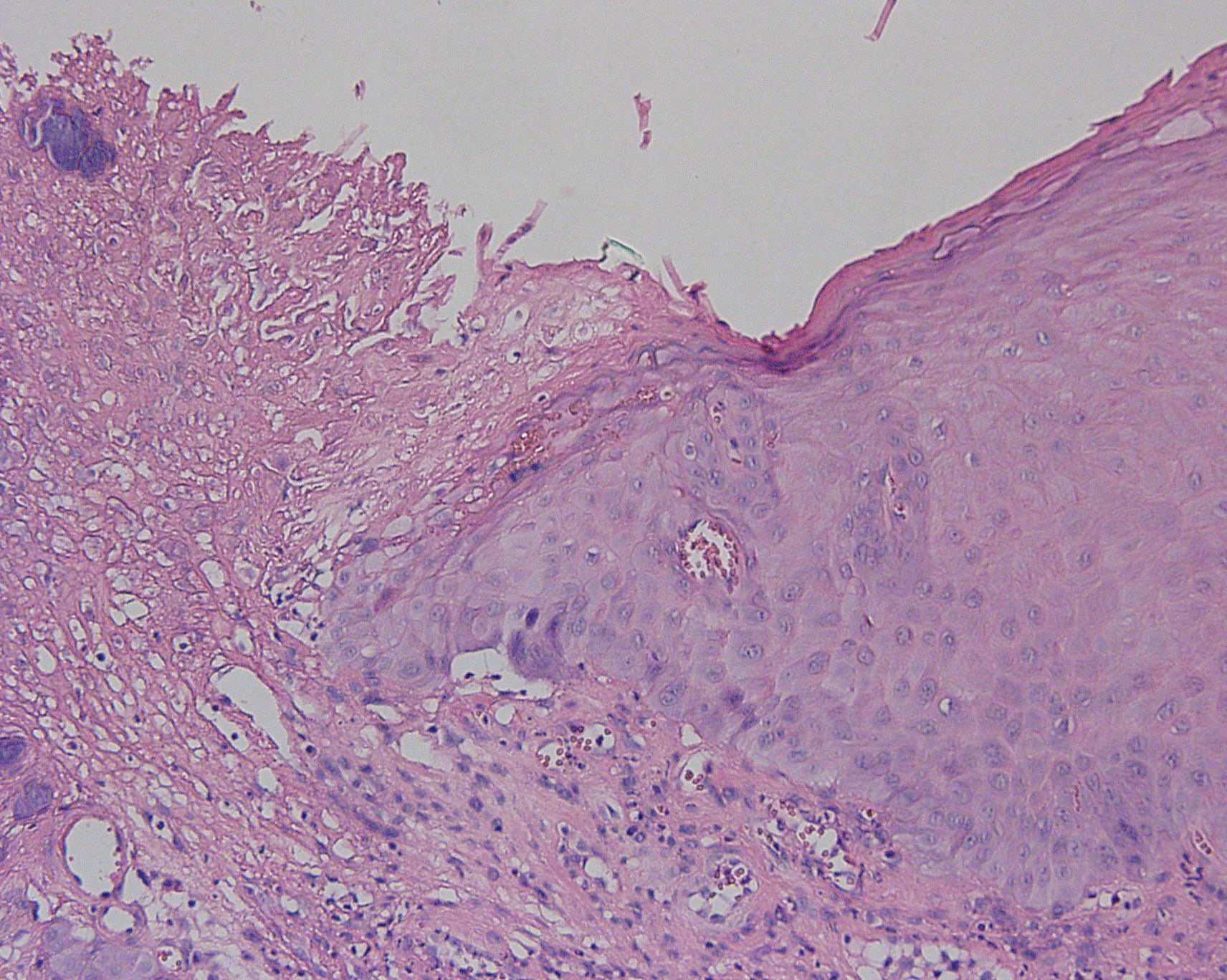 b
b 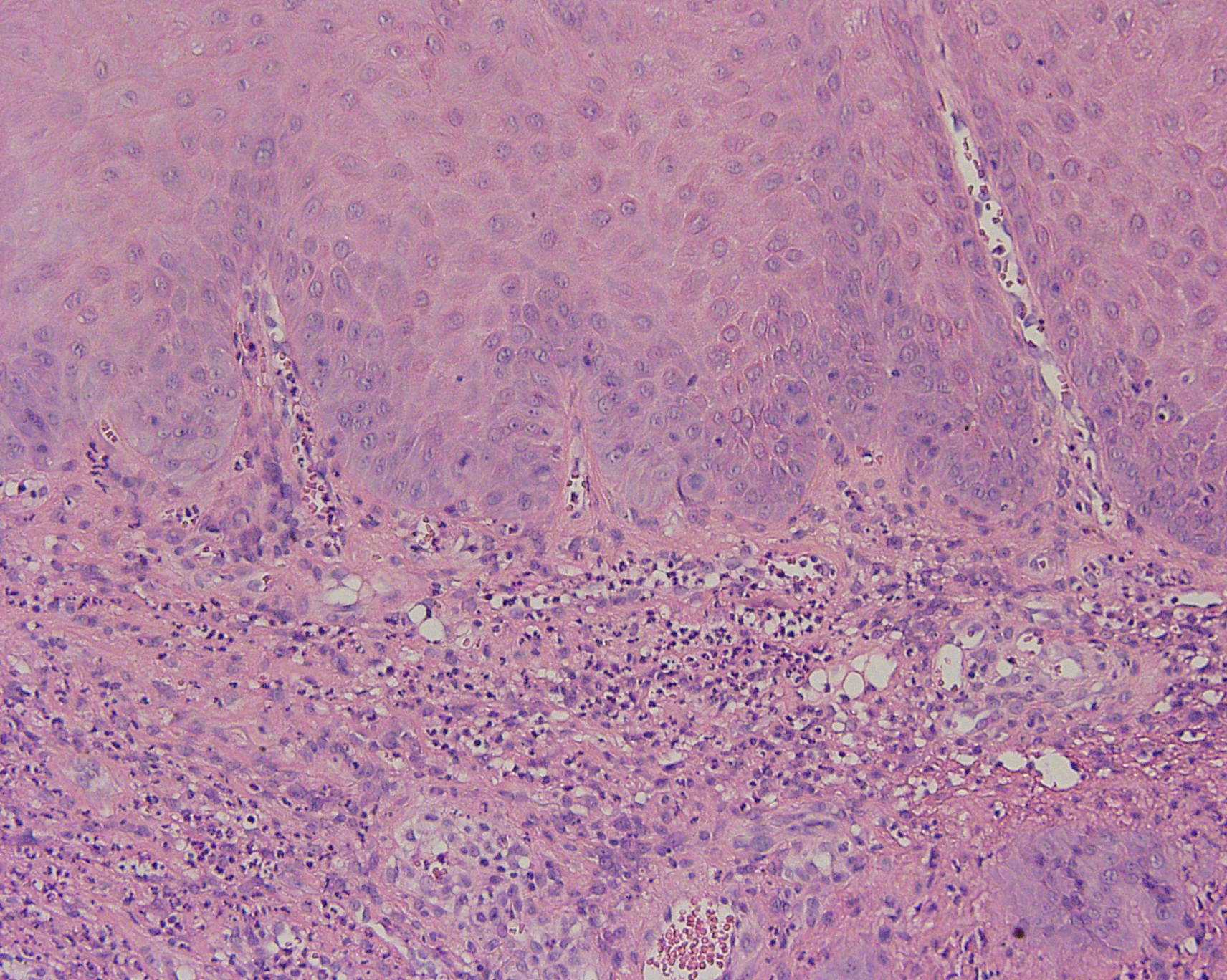 c
Fig. 1. Regeneración
epitelial en úlcera de la mucosa oral (corresponde a biopsia
tomada en lesión de piso de boca). Se observa en a, malla de
fibrina (x), y
epitelio adelgazado por debajo de dicha malla de fibrina. En b, mayor
aumento del límite de la malla de fibrina con el epitelio, se
observa al extremo superior izquierdo colonias bacterianas
(basófilas), y en c, bajo el epitelio adyacente a la
úlcer, en corion se observa infiltrado inflamatorio, y en
estrato parabasal algunas mitosis.
c
Fig. 1. Regeneración
epitelial en úlcera de la mucosa oral (corresponde a biopsia
tomada en lesión de piso de boca). Se observa en a, malla de
fibrina (x), y
epitelio adelgazado por debajo de dicha malla de fibrina. En b, mayor
aumento del límite de la malla de fibrina con el epitelio, se
observa al extremo superior izquierdo colonias bacterianas
(basófilas), y en c, bajo el epitelio adyacente a la
úlcer, en corion se observa infiltrado inflamatorio, y en
estrato parabasal algunas mitosis.
El epitelio respiratorio e intestinal
tiene
buena capacidad de reparación, igualmente el de las mucosas
oral,
esofágica, laríngea. El tejido hepático y renal
tiene
capacidad reparativa variable. En el hígado se conoce que la
extirpación
de 3/4 partes (en animales de experimentación), es seguida por
una
rápida reparación. En el humano se conoce que la
hepatitis
viral, que produce necrosis por zonas, se acompa&ntildéa de
una buena reparación, en ni&ntildéos, por ejemplo en
la hepatitis A, no así en el adulto con la hepatitis B.
También
en la cirrosis hepática del alcohólico al haber
destrucción
de la trama de fibras reticulares y menor aporte sanguíneo, no
se
produce una reparación sino un reemplazo por tejido fibroso
cicatrizal.
En el riñón, los
glomérulos no tiene capacidad reparativa, y son reemplazados por
tejido fibrosos que se hialiniza, proceso que ocurre en
glomerulonefritis
necrotizante. Sin embargo, en necrosis aguda de los túbulos hay
una buena reparación de éstos.
Referencias Bibliográficas:
NOTA:Consulte las referencias que
aparecen
en los Ciclos de Práctica I y II.
Retroalimentación
1.- El epitelio cuando está en
regeneración
realiza tres procesos:
2.- Cuando un epitelio se regenera, lo
hace por unas sustancias llamadas........................, o
...................
3.- La reparación del
hígado
y riñón depende de :
a. integridad de los vasos sanguineos
b. magnitud de la injuria
c. malla fibrilar intacta
d. todas las anteriores.
CICLO DE PRACTICA IV
Reparación de fibras nerviosas
Las neuronas como ya ha sido
se&ntildéalado
son células perennes, sin capacidad de multiplicarse. Por lo
tanto,
cuando se produce su necrosis son reemplazadas por el tejido de
sostén
del SNC (o sea por la glia: astrocitos, oligodendrocitos y microglia).
Después de la muerte de la neurona continúa su
degeneración
y la del axón. Las células de la glía fagocitan
estos
detritos celulares y proliferan. Si la necrosis en el cerebro, o cuerda
espinal, es de proporciones, se forma una cavidad que se llena de un
líquido
amarillento aceitoso, rodeada por los astrocitos los que producen
fibrillas
que pueden llegar a constituir una cicatriz fibrosa. Este proceso se
llama
gliosis, y ocurre generalmente en casos de infarto cerebral.
Es diferente en los nervios
periféricos.
Después de seccionarse una fibra nerviosa hay una
degeneración
Walleriana, el axón distal a la injuria, sufre
desintegración
de su vaina, que es fagocitada como gotas lipídicas.
Posteriormente
las células de la vaina de Schwann proliferan formando cordones.
si este da&ntildéo está cerca a la neurona, puede
haber
cromatolisis y muerte celular. Generalmente, la neurona no presenta un
da&ntildéo irreversible y hay proliferación de
neurofillas
del axón que entre más cerca está al extremo
distal
más rápido va a ser encontrado y poder reunirse
células
de Schwann de ambos extremos. En condiciones ideales se habrá
formado
una unión con reparación de la vaina de mielina y un
nuevo
perineurio. Esta reparación depende fundamentalmente de la
separación
existente entre los cabos; se sabe que las neurofibrillas crecen 3 mm
diarios.
A veces esta separación es muy grande y la proliferación
de neurofibrillas y células de Schwann forman un nódulo
doloroso
llamado "Neuroma traumático".
Reparación del Tejido Muscular
El músculo estriado y liso,
tiene
poca capacidad reparaiva sólo hay generalmente un reemplazo por
cicatriz fibrosa. Así ocurre después de un infarto del
miocardio,
la necrosis del músculo es finalmente reemplazada por cicatriz
fibrosa.
A veces cuando hay injuria por toxinas
bacterianas, se produce en el músculo esquelítico la
degeneración
de Zenker, en que hay necrosis de fibras musculares individualmente, y
a partir de brotes como yemas puede haber regeneración del
sarcoplasma,
con restitución de la continuidad del músculo. En
operaciones
al intestino (delgado o grueso), en que se compromete músculo
liso,
se sabe que hay una reparación por tejido fibroso, en que la
función
no queda alterada. Igualmente ocurre al suturar un músculo
estriado
esquelético.
Referencias Bibliográficas
-
Ordman, I. J. and Gillman, T. :
Studies in
the healing of cutaneous Wounds. Arch Surg. (Chicago) 93:857- 882,
883-910.
911-928 1966.
Retroalimentación
1.- Entre más cerca a una
neurona,
la sección del axón provoca:
a. cromatolisis
b. necrosis celular
c. regeneración de la fibra
d. a y b son correctas
2.- La glia está
constituída
por:
3.- Las intervenciones
quirúrgicas
del intestino son muy peligrosas por su pobre cicatrización.
CICLO DE PRACTICA V
Reparación Osea
De acuerdo a Israel la
reparación
post-fractura puede dividirse en 3 fases arbitrarias:
-
Demolición y formación
del tejido
de granulación. Inmediatamente despué;s de la fractura,
entre
los fragmentos óseos se produce una hemorragia, o hematoma, que
tiene algunas espículas óseas; éstas, más
las
zonas necróticas del hueso deben ser fagocitadas y aparecen
macrófagos,
osteoclastos y PMN, que redondearán los bordes de la fractura,
simultáneamente
exite proliferación de capilares en la zona y aumentan los
fibroblastos,
formando el tejido de granulación, en el cual empieza a
formarse
fibra colágenas que van a llegar al cabo de una semana a unir
los
fragmentos óseos, siempre que estén dadas las condiciones
favorables para que ello ocurra.
-
Formación del callo provisorio.
Los
fibroblastos además secretan osteomucina entre las fibras
colágenas,
que van a contribuir a formar la matriz del hueso, en este momento
llamado
ostoide al cual se le van a depositar sales de calcio para formar un
hueso
fibroso. Algunos fibroblastos como vemos, se han diferenciado en
osteoblastos
pero otros probablemente por un menor aporte vascular se diferencian en
condroblastos y habrá áreas de cartílago hialino.
Así este callo provisorio consiste de hueso fibroso y
cartílago
hialino, el cual une los fragmentos óseos. Mientras tanto en el
periostio se han diferenciado inicialmente osteoclastos y
posteriormente
osteoblastos, que recuerdan el aspecto del periostio fetal. Aquella
actividad
de reabsorción ósea que realizan los osteoblastos y
aposoción
de hueso se conoce como remodelamiento. En el momento que se ha formado
el callo provisorio (2 semanas) se inicia la calcificación,
probablemente
por la abundante presencia de fosfatasa alcalina en los osteoblastos, y
de fosfatos en el suero.
-
Formación del callo definitivo:
Posteriormente
se produce reabsorción del hueso fibroso y del cartílago,
predominando la presencia de osteoblastos y vasos sanguíneos,
los
que irán depositando hueso laminillar, para constituir
nuevamente
sistemas Haversianos. Simultaneamente habrá una verdadera
formación
de la cortical ósea, que resulta, en parte, del reemplazo del
hueso
formado en el área del llamado callo externo. El callo interno
está
en el medio del canal medular y es reemplazado por hueso trabecular. El
callo intermedio también formará hueso de la cortical y
está
entre ambos fragmentos. Poco a poco se produce remodelamiento
óseo
por la acción osteoblástica y osteoclástica para
terminar
la reparación alrededor de los 6 meses. Por eso una fractura en
un adulto, son casi 6 meses de licencia médica.
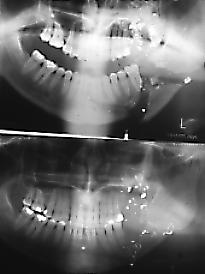
Fig. 2. Fractura de zona
ángulo mandibular, con varios rasgos, debido a herida por bala.
Zonas más radio-opacas corresponden a restos del proyectil. En
la
radiografía inferior se aprecia la reparación un
año
después, hubo pérdida de molar. Imágenes
gentileza
de los Drs. Alamo y Silva.
Reparación del alvéolo
post-extracción dentaria
Esta es parecida a la reparación
de una fractura, salvo que el periostio no tiene ningún rol.
Inicialmente
después de la extracción de una pieza dentaria se forma
un
coágulo, al cual llegan brotes vasculares y células
inflamatorias
desde los espacios medulares. Posteriormente este tejido de
granulación
es reemplazado por hueso trabecular laminillar. Debido a que el reborde
alveolar cuando ya no tiene piezas dentarias y estas no han sido
reemplazadas,
ya no tiene funciones que cumplir sufre fenómenos de
remodelamiento
marcado y a la larga encontraremos un reborde atrofiado, malo para la
retención
de prósis.
Si en los primeros días, el
coágulo
se pierde e infecta se formará un alvéolo seco, el cual
es
muy doloroso debido a la necrosis del hueso. Existen diversas razones
por
las cuales puede producirse esta complicación de la
extracción
dentaria, entre ellas un aumento de la actividad fibrinolítica.
Referencias Bibliográficas:
-
Israel, M.S. : "The reaction of bone
to trauma
and infection" in Scientific Foundations of Dentistry, Cohen R. and
Kramer.
I.R.H. Year Book Med. Pub. Chicago, 1976, Chap. 47 pags. 567-568.
-
Simpson, H. E.: The healing of
extraction
wounds. Brit. Den. J. 126(12): 550-557, 1969.
Retroalimentación
1.- ¿Cuál es el rol del
callo
óseo externo?
2.- Es ideal que antes de la
formación
de hueso en la fractura se elimine el hueso necrótico y las
espículas
óseas que puedan estar presentes.
3.- ¿Cuál de los
siguientes
tejidos no tienen importancia en la reparación alveolar?
a. periostio
b. médula ósea
c. tejido de granulación
d. periodonto
4.- De acuerdo a estas imágenes
de reparación del alvéolo dentario, describa lo que
observa:
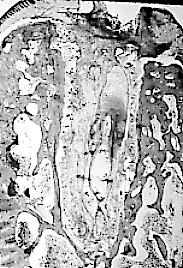
Fig. 3a. Alvéolo
tres días después de la extracción dentaria,
realizada
con forceps.
(Muestras corresponden a
alvéolos dentarios de monos rhesus).
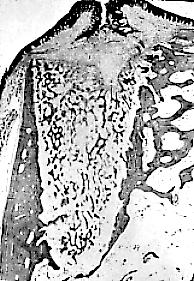
Fig. 3b. Reparación
del alvéolo a las 4 semanas, se observa ya trabeculado
óseo
esponjoso.
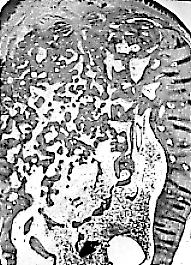
Fig. 3c. A las 8 semanas,
crestas alveolares ya están remodeladas, note su aspecto
redondeado,
y el alveolo presenta mucho mayor formación de hueso esponojo.
Fig. 3a, b y c. (Estas
tres
microfotografías fueron tomadas de: Simpson HE, The Healing of
extraction
wounds. Brit Dent J. 1969; 126:550-557. Es difícil conseguir
imágenes
histológicas del proceso de reparación del alvéolo
dentario en seres humanos).
Test
Final
Mis opiniones acerca de esta Unidad
¿Algún comentario?, escriba
a:
Dr.
Benjamín Martínez R.
 a
a  b
b  c
c


