Facultad de Odontología
Patología General y Oral
Elementos de Inmunología
Introducción
El sistema inmune humano es verdaderamente una sorprendente constelación de respuestas a los ataques del exterior. Posee muchas facetas, muchas de las cuales pueden cambiar la respuesta a estas intrusiones indeseables. Este sistema es bastante efectivo la mayor parte del tiempo. Les daremos una breve visión de los procesos involucrados en estas respuestas.
Un antígeno (Ag) es cualquier sustancia que desencadene una respuesta inmune, desde un virus hasta macromoléculas de mayor tamaño.
El sistema inmune posee una serie de naturalezas duales, siendo la más importante la capacidad de reconocer lo propio y lo no propio. Las otras son: general/específico, natural/adaptativo = innato/adquirido, celular/humoral, primario/secundario, activo/pasivo. Partes del sistema inmune son antígeno específicas (ellas reconocen y actúan en contra de Ag específicos), sistémicas (no confinadas al sitio de infección inicial, sino que funcionan a través del cuerpo) y tienen memoria (reconocen y montan un ataque cada vez más fuerte contra el mismo Ag en una próxima oportunidad).
El reconocimiento de lo propio y de lo no propio es posible por la existencia de marcadores conocidos como complejo mayor de histocompatibilidad (MHC). Cualquier célula que no posea este marcador es considerada como extraña y, por tanto, atacada. El proceso es tan efectivo que proteínas no digeridas son tratadas como antígenos.
A veces el proceso falla y el sistema inmune ataca
células propias. Esto es lo que sucede en las enfermedades autoinmunes
como el lupus eritematoso sistémico (LES) y algunas formas de artritis
y diabetes. Hay veces en que la respuesta inmune frente a sustancias inocuas
es inapropiada. Este es el caso de las alergias en que la sustancia que
desencadea el proceso se conoce como alergeno.
El sistema sanguíneo.
En un adulto de 70 Kg los 5 litros de sangre que posee constituyen el 7% del peso corporal. La sangre fluye desde el corazón a las arterias, luego a los capilares y regresa al corazón a través de las venas.
La sangre está compuesta por 52-62% de plasma y 38-48% de células. El plasma es principalmente agua (91,5%) y actúa como solvente para el transporte de otros materiales (7% proteínas –consistente en 54% de albúmina, 38% de globulinas, 7% de fibrinógeno, 1% de otras proteínas- y 1,5% de otras sustancias). La sangre es ligeramente alcalina (pH = 7,4 ± 0,05) y un poco más densa que el agua (densidad = 1,057 ± 0,009).
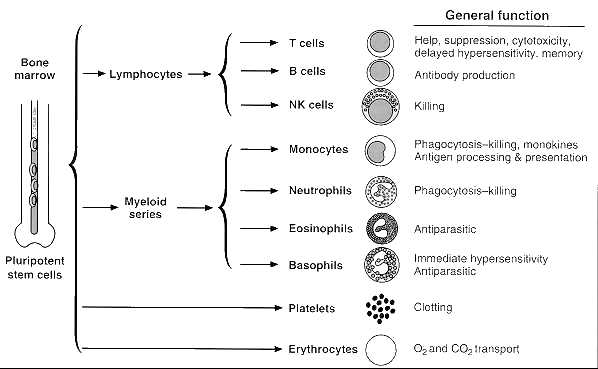
Todas las células sanguíneas se originan de células troncales, las cuales se encuentran principalmente en la médula ósea, en un proceso llamado hematopoiesis. Las células troncales producen hemocitoblastos que se diferencian en los precursores de todas las diferentes células sanguíneas. Los hemocitoblastos maduran hacia tres tipos de células, a saber: eritrocitos, leucocitos y trombocitos.
Los leucocitos, a su vez se subdividen en granulocitos (que contienen grandes gránulos en su citoplasma) y agranulocitos (sin gránulos). Los granulocitos consisten en neutrófilos (55-70%), eosinófilos (1-3%), y basófilos (0,5-1%). Los agranulocitos son los linfocitos (células T y B) y los monocitos. Los linfocitos circulan por la sangre y el sistema linfático y se "almacenan" en los órganos linfoides.

Figura1: Principales células del sistema sanguíneo.
Hay entre 5000 y 10000 células blancas por
mm3 y viven 5-9 días. Las células rojas viven
alrededor de 120 días (migran al bazo para morir. Una vez allí,
este órgano limpia las proteínas útiles de los restos
celulares). Un varón adulto sano tiene alrededor de 5 millones de
glóbulos rojos por mm3, mientras que las mujeres presentan
un poco menos de 5 millones.
El sistema linfático
La linfa es un fluido alcalino (pH > 7,0) que normalmente es claro, transparente e incoloro. Fluye por los vasos linfáticos y baña los tejidos y órganos. No hay glóbulos rojos en la linfa y posee un contenido más bajo de proteínas que la sangre. Como la sangre, es levemente más pesada que el agua (densidad = 1,019 ± 0,003).
La linfa fluye desde el líquido intersticial a través de los vasos linfáticos hasta el conducto torácico o ducto linfático derecho, los que terminan en las venas subclavias, donde la linfa se mezcla con la sangre (El conducto linfático derecho tributa del lado derecho del tórax, cabeza y cuello, mientras que el conducto torácico tributa del resto del cuerpo). La linfa acarrea lípidos y vitaminas liposolubles absorbidas en el tracto gastrointestinal. Los vasos linfáticos, como las venas, poseen válvulas que impiden el reflujo. Adicionalmente, a lo largo de estos vasos hay pequeños linfonodos que sirven como filtros del flujo linfático. Es en estos linfonodos donde el antígeno normalmente es presentado al sistema inmune.
El sistema linfoide humano está compuesto por:
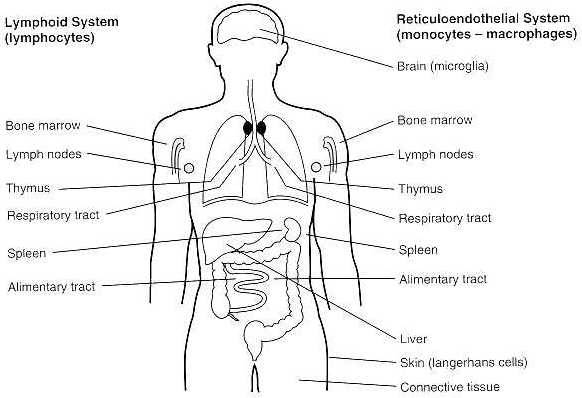
Figura 2: Sistema linfoide.
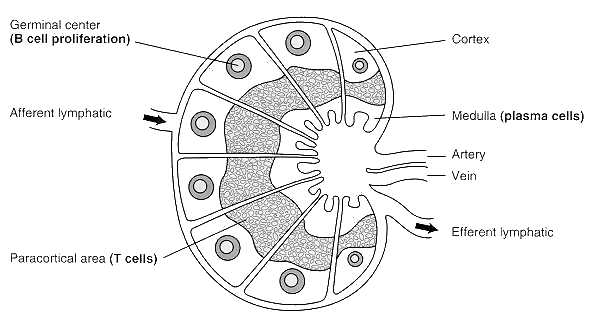
Figura 3: Linfonodo
Inmunidad natural o innata
La inmunidad natural es con la que nacemos y es inespecífica; todos los antígenos son atacados por igual con similar intensidad, dañando indiscriminadamente a los tejidos y está determinada genéticamente. Hay ciertas interacciones que permiten a la respuesta innata erradicar agentes infecciosos, a saber: fagocitosis, opsonización y lisis mediada por complemento; pero todas ellas requieren de la superficie del microorganismo. La respuesta, por tanto, está confinada a microorganismos extracelulares, principalmente bacterias. Este tipo de inmunidad no es capaz de detectar organismos intracelulares como virus, micobacterias, algunos hongos, protozoos y otros patógenos intracelulares facultativos.
Inmunidad de las mucosas
La flora normal se encuentra en casi todos los nichos ecológicos disponibles en el cuerpo y producen bacteriocidinas, defensinas, proteínas catiónicas y lactoferrina, todas las cuales se encargan de destruir otras bacterias que compiten por sus nichos en el cuerpo.
Las bacterias residentes pueden llegar a ser un problema cuando invaden los espacios donde no deberían estar. Por ejemplo, los estafilococos que viven en la piel pueden entrar al cuerpo a través de un pequeño corte; algunos antibióticos, particularmente la clindamicina, destruyen algunas de las bacterias de nuestro tracto intestinal. Esto provoca un sobrecrecimiento del Clostridium difficile, lo cual resulta en una colitis seudomembranosa, condición dolorosa en la cual el recubrimiento interno del intestino se desprende y sangra.
Un fagocito es una célula que es atraída (por quimiotaxis), se adhiere, envuelve e ingiere un cuerpo extraño. Los promonocitos son hechos en la médula ósea, después de lo cual son liberados al torrente sanguíneo y se los llama monocitos circulantes, los que eventulamente maduran a macrófagos.
Algunos macrófagos se concentran en los pulmones, el hígado (células de Küpffer), linfonodos y bazo, microglia cerebral, células mesangiales del riñón, células sinoviales tipo A y osteoclastos. Tienen una larga vida, las mitocondrias les aportan la energía y son muy buenas destruyendo células muertas y patógenos que viven dentro de las células. Una vez que un macrófago fagocita una célula, ubica algunas de sus proteínas, llamadas epitopos, en su superficie, como si fuera un plano de lucha. Estos marcadores de superficie sirven como una alarma para otras células inmunes que pueden inferir la forma del invasor. Todas las células que hacen esto se llaman células presentadoras de antígenos (APC = antigen presenting cells).
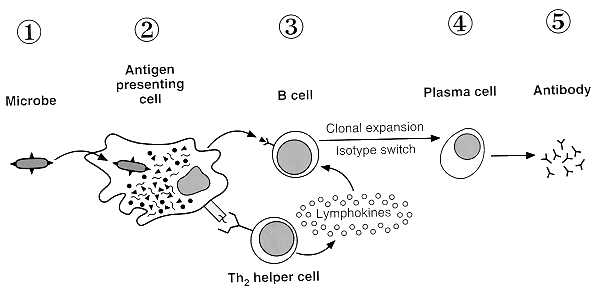
Figura 4: Presentación antigénica a
células Th2 que activan células B las que diferenciarán
a plasmocitos y producirán anticuerpos. No se muestra presentación
a células Th1.
Las células natural killers navegan por la sangre y linfa para lisar células cancerosas y células infectadas por virus. Ellas son linfocitos granulares grandes que se unen a las glicoproteínas de superficie de las células infectadas y las destruyen. Reconocen a las células anormales de dos modos. Primero, ellas poseen receptores de inmunoglobulinas (FcR) y se unen a células diana (target) recubiertas por anticuerpos, induciendo una citotoxicidad celular dependiente de anticuerpos (ADCC). En segundo lugar, ellas poseen receptores en su superficie para MHC clase I. Si en una interacción con una célula este receptor no encuentra su ligando la natural killer lisa a la célula target. Esto se lleva a cabo por la secreción de perforinas hacia la superficie de la célula a la que la natural killer se ha adherido. Las perforinas hacen agujeros en la membrana celular a través de los cuales se inyectan granzimas. Las granzimas inducen apoptosis en la célula target. Las células normales del hospedero son MHC clase I positivas y la unión de esta molécula a su receptor en la natural killer inhibe este patrón de muerte. Las células tumorales y los virus (especialmente los de la familia herpes) a menudo inducen una downregulation de clase I. Aunque esto último puede dar una cierta ventaja a los patógenos para no ser reconocidos por las células T citotóxicas, los deja susceptibles a la acción de las natural killers (como veremos más adelante).
Tabla 1. Características principales y funciones de las células mononucleares.
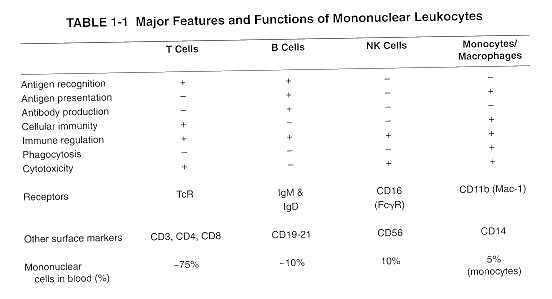
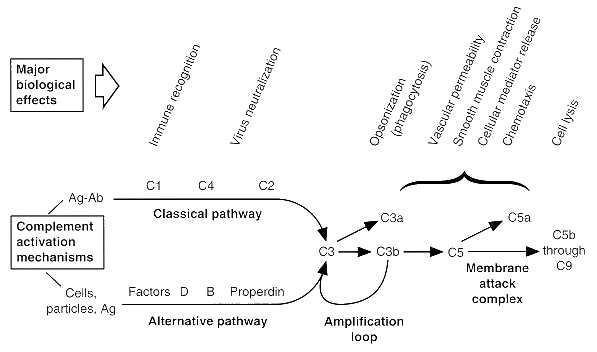
Figura 5: Vías clásica y alternativa
de la cascada del complemento
Ahora bien, el sistema del complemento consiste en al menos 20 glicoproteínas séricas, algunas de las cuales cumplen funciones regulatorias. Estas son activadas en una cascada con diferentes etapas de amplificación. Esto significa que la activación de una sola molécula puede llevar a que se generen otras miles de moléculas. Hay tres patrones de activación del complemento que están dadas por a) una substancia foránea (uniones lectina y manan a residuos de manosa), b) la vía clásica activada por uniones antígeno-anticuerpo, c) la vía alternativa por polisacáridos de hongos y bacterias Gram negativas (Figura 5). El patrón recientemente identificado de uniones tipo manan-lectina lleva a la activación de la vía clásica al activarla independientemente del complejo C1rs y se estimula por las proteínas que contienen manosa y carbohidratos en los microorganismos, incluyendo virus y hongos. Muchos de los componentes de las vías clásica y alternativa son homólogos, sugiriendo que ambos patrones originalmente derivaban de la misma secuencia. Los tres patrones convergen en la activación del componente central C3. Esto lleva a la vía final común con el ensamblaje de C5-C9, formándose un poro transmembrana (complejo de ataque a membrana) en la superficie celular y la muerte por lisis osmótica. Las perforinas que son producidas por los linfocitos T citotóxicos y los natural killers tienen una estructura similar. La activación del complemento se focaliza en la superficie de una célula u organismo, formándose un sitio protegido de aquellas proteínas inhibitorias que poseen un acceso limitado a estas superficies celulares. Las células normales del hospedero poseen receptores de complemento tipo 1 y factor retardador del aceleramiento (DAF), los que inhiben a la C3 convertasa y previene la progresión de la activación del complemento. Sin embargo a los microorganismos les faltan estas moléculas y son, por tanto, susceptibles a la acción del complemento.
Además de la lisis de microorganismos, el complemento posee otras funciones contra las infecciones. C3b posee una acción de opsonina, está también la liberación de C3a y C5a que son anafilotoxinas y aumentan la permeabilidad vascular para penetrar a los tejidos , finalmente, C5a posee una acción quimiotáctica para atraer el infiltrado inflamatorio. El complemento tiene también un rol dentro de la respuesta inmune específica; su activación y depósito dentro de complejos inmunes ayuda marcarlos para que sean reconocidos por receptores de complemento de células APC, como los linfocitos B y células dendríticas foliculares.
Los eosinófilos son atraídos hacia células recubiertas con C3b, donde ellos liberan una proteína básica mayor (MBP), proteínas catiónicas, perforinas, peroxidasa eosinofílica y neurotoxina derivada de eosinófilos, todos los cuales trabajan para formar agujeros en células y helmintos. Normalmente estas infecciones por nematodos inducen la producción de IgE que recubre al microorganismo. Los eosinófilos se unen al anticuerpo usando sus receptores de baja afinidad (Fce RII). Si bien algunos postulan que los eosinófilos son fagocitos, otros postulan que, más bien, su acción está dada por la liberación de las substancias arriba mencionadas desde sus gránulos. Alrededor del 13% de las células blancas son eosinófilos. Su vida es de 8-12 días.
Aunque los basófilos y los mastocitos son relativamente escasos comparados con las otras células blancas, ellos están implicados en algunas de las más severas reacciones inmunológicas, como el angioedema y la anafilaxis. Hay al menos dos poblaciones de mastocitos de acuerdo a las enzimas que contienen y su localización tisular. Los mastocitos T (de las mucosas) sólo contienen tripsina, mientras que los mastocitos del tejido conectivo contienen tripsina y quimiotripsina. Los basófilos son células circulantes morfológicamente similares a los mastocitos. Ambos tipos de células poseen receptores de alta afinidad para IgE Fce RI (CD23) los que rápidamente absorben cualquier IgE local. El enlace cruzado de estos receptores por la unión del antígeno a IgE lleva a la degranulación y liberación de mediadores preformados, como aminas vasoactivas, histamina y serotonina. Mediadores derivados de membrana como leucotrienos B4, C4, D4 y E4, prostaglandinas y factor activador de plaquetas también son producidos en estas células y son responsables del aumento de la permeabilidad vascular, broncoconstricción e inducción de la respuesta inflamatoria.
Las células dendríticas están cubiertas por una masa de procesos membranosos que los hacen lucir como células nerviosas dendríticas. La mayor parte de ellas son muy eficientes como células presentadoras de antígenos. Hay cuatro tipos básicos: células de Langerhans, células dendríticas intersticiales, interdigitantes y circulatorias. Nos concentraremos en las células de Langerhans que se encuentran en la epidermis y membranas mucosas, especialmente en el ano, vagina y cavidad oral. Estas células atraen antígenos y los presentan de modo muy eficiente a células T helper para su activación.
Cada una de las células en el sistema inmune
inespecífico se une a los antígenos usando receptores que
poseen un determinado patrón de reconocimiento. Estos receptores
son codificados en la línea germinal de cada persona. En el curso
del desarrollo humano estos receptores para patrones moleculares asociados
a patógenos han evolucionado por selección natural para ser
específicos para ciertas características de amplias clases
de microorganismos infecciosos. Hay varios cientos de estos receptores
y ellos reconocen patrones de lipopolisacáridos bacterianos, peptidoglicanes,
DNA bacteriano, RNA de doble cadena y otras substancias. Claramente ellos
están activados para actuar sobre bacterias Gram positivas y Gram
negativas.
Inmunidad adaptativa, adquirida o específica
Los linfocitos se dividen en dos tipos: células T y células B. La sangre periférica contiene 20-50% de los linfocitos circulantes; el resto se mueve en el sistema linfático. Aproximadamente el 80% de ellos son células T, el 15%, células B y las restantes son células nulas o indiferenciadas. Los linfocitos constituyen el 20-40% de las células blancas del organismo. Su masa total es más o menos la misma que la del cerebro o el hígado.
Las células B se producen en las células madre de la médula ósea. Ellas producen anticuerpos y modulan la inmunidad humoral. Las células T son linfocitos no productores de anticuerpos que también son producidos en la médula ósea pero sensibilizados en el timo y constituyen la base de la inmunidad mediada por células.
Las células que salen desde la médula ósea y el timo y que han experimentado un reordenamiento génico (ver más adelante) son vírgenes (naive), es decir, no han encontrado su antígeno específico dentro de una respuesta inmune. Estas células llenan los tejidos linfoides secundarios de los linfonodos, bazo, tonsilas y tejido linfoide asociado a mucosas. Debido a que sólo unas pocas células T y B vírgenes son capaces de reaccionar específicamente con una partícula foránea, para que se encuentren con su antígeno específico tiene que haber un sistema que los reúna (antígeno y célula). Los tejidos linfoides (Figuras 1 y 2) proveen el microambiente para este proceso. Estos tejidos, además de las células T y B, poseen células presentadoras de antígenos y son capaces de producir citoquinas que mantienen a las células T y B. Los tejidos linfoides expresan moléculas de adhesión de un modo secuencial, permitiendo a las células moverse dentro de los tejidos y aumentando las oportunidades de que los linfocitos entren en contacto con los antígenos.
Para que las células trabajen efectivamente ellas necesitan ser reclutadas a los sitios de inflamación y allí ser activadas. Esto se lleva a cabo por la interacción de receptores celulares, que transducen señales al núcleo, y factores externos, como las citoquinas, son capaces de unirse a los receptores y con otras moléculas de adhesión.
Las moléculas de adhesión son moléculas de superficie que participan en las interacciones célula-célula. Su principal función es facilitar procesos en donde se requiere un contacto íntimo entre las células, por ejemplo, dirigiendo la migración celular, fagocitosis y la citotoxicidad celular. Las moléculas de adhesión se asocian con proteínas citoplasmáticas y con componentes del citoesqueleto para provocar una reorganización del citoesqueleto, permitiendo a las células experimentar un determinado movimiento. Las señales de transducción que se inducen luego de la unión de las moléculas de adhesión, además permiten la activación celular, alteración en la expresión de receptores, producción de citoquinas y efectos en la sobrevida celular. Las células pueden expresar moléculas de adhesión constitutivamente o sobrerregularlas al ser expuestas a citoquinas, quimioquinas u otras moléculas proinflamatorias, tales como productos de activación del complemento y metabolitos microbianos. Algunas moléculas de adhesión se expresan principalmente en leucocitos, otras, en células endoteliales, estimulando la interacción entre ambos tipos celulares (Tabla II).
Tabla II: Origen y función de citoquinas.
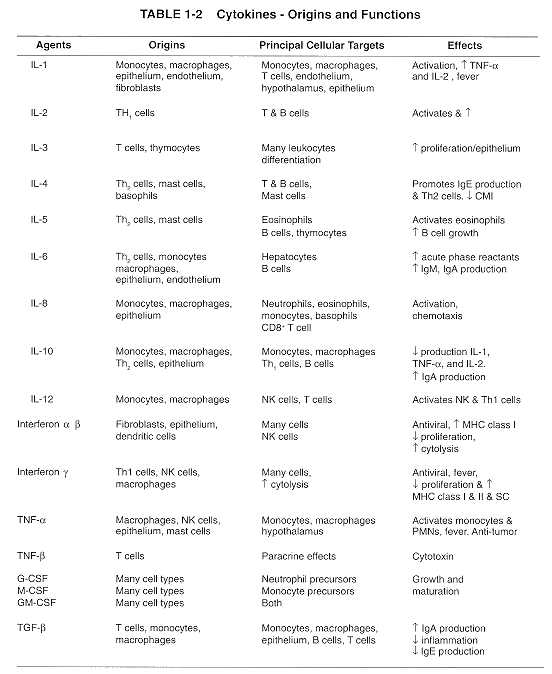
Los interferones tipo 1 (a y b) tienen una potente actividad antiviral son producidos principalmente por los fibroblastos y monocitos como una reacción a la infección. Los interferones a y b se unen al mismo receptor celular y protegen a las células no infectadas al inducir la protección intracelular de moléculas que inhiben o interfieren la producción de DNA y RNA virales. Los interferones aumentan la expresión de moléculas MHC clase I lo que aumenta la capacidad de reconocimiento de células infectadas por virus por parte de linfocitos T citotóxicos. Los interferones tipo 1 también tienen funciones antiproliferativas. El interferón a se usa en el tratamiento de las hepatitis B y C en combinación con drogas antivirales, así como en algunas formas de leucemia. El interferón b reduce la tasa de recidiva de un subgrupo de pacientes con esclerosis múltiple. El interferón g tiene diferentes funciones, estimula directamente el sistema inmune para estimular macrófagos y neutrófilos, estimula la función de células natural killers, la presentación antigénica al aumentar la expresión de MHC clase II en células APC. El interferón g sólo es producido por células del sistema inmune y usa un receptor distinto al de los interferones tipo 1. Su utilización está en el tratamiento de defectos congénitos específicos de los neutrófilos (enfermedad granulomatosa crónica) y en pacientes con defectos en la producción de interferón g o de su receptor y como terapia adyuvante en infecciones por defectos macrofágicos (leishmaniasis, enfermedad micobacteriana atípica).
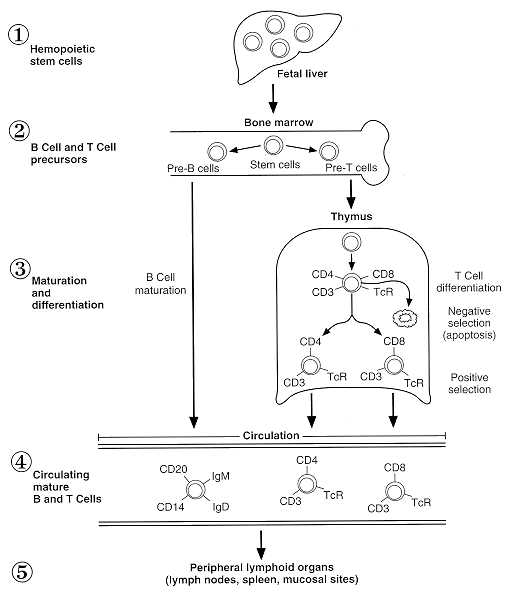
Figura 6: ontogenia de células B y T
Inmunidad mediada por células
Los macrófagos engullen antígenos, los procesan internamente y entonces presentan partes de ellos en su superficie junto con moléculas (proteínas) propias. Sabemos que todas las células están cubiertas con varias substancias. CD significa grupos de diferenciación (clusters of differentiation) y hay más de 160 grupos, cada uno de los cuales es una molécula química diferente que cubre la superficie celular. CD8+ se lee "CD8 positiva". Cada célula T o B tiene alrededor de 105 moléculas en su superficie. Las células B están cubiertas con CD19, CD20, CD21, CD35, CD40, y CD45, además de otras moléculas no CD. Las células T tienen CD2, CD3, CD4, CD8, CD45R y otras moléculas no CD en su superficie.
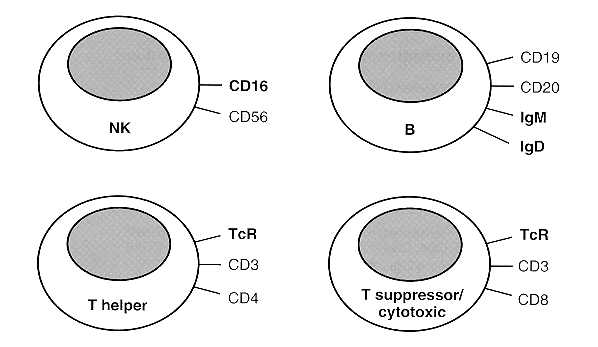
Figura 7: Marcadores de superficie de linfocitos.
La unión del antígeno a receptores específicos de las células T o B inducen las respuestas efectoras en dos etapas. Primero, el antígeno es presentado a y reconocido por una célula T o B lo que lleva al cebamiento o preparación, activación y diferenciación, lo cual normalmente ocurre dentro de compartimentos especializados del tejido linfoide. En segundo lugar, la respuesta efectora tiene lugar debido a células T activadas que dejan el tejido linfoide y vuelven al sitio de la enfermedad o debido a la liberación de anticuerpos por células B activadas (plasmocitos) a la sangre o los fluidos tisulares y, de este modo, a los focos de infección.
Las células T se diferencian en el timo - al que llegan tempranamente después de haber sido producidas en la médula ósea - donde sufren dos procesos de selección. El primero es un proceso de selección positiva, donde sólo sobreviven aquellas células T con el correcto set de receptores que pueden reconocer moléculas MHC responsables del autorreconocimiento. Luego comienza un proceso de selección negativa donde sólo células T que reconocen moléculas MHC acomplejadas con péptidos foráneos se les permite salir fuera del timo. Ahora bien, el proceso de producción de receptores específicos de antígeno en las células T o TCR (y también en las células B) es el resultado de un inusual proceso de reordenamiento aleatorio y "splicing" de múltiples segmentos de DNA que codifican aquellas áreas del receptor que se unirán específicamente a los antígenos (regiones determinantes de complementariedad –CDR -). El reordenamiento génico ocurre tempranamente en el desarrollo celular (lo veremos con detalle más adelante), antes de la exposición al antígeno, lo que lleva a la producción de un repertorio de sobre los 108 receptores de célula T (TCR) y 1010 especificidades de anticuerpos, adecuados para cubrir el rango de patógenos a los que nos expondremos durante la vida. En los linfocitos T el TCR tiene dos formas. La más común consiste en un heterodímero de cadenas a y b, cada una con un dominio constante y variable (Figura 8). La otra forma (menos del 10% de células T) presenta cadenas g y d (la función de este tipo de TCR permanece incierta). El TCR forma un complejo con la molécula CD3, con sus moléculas de señalización asociadas.
Una vez que el reordenamiento de la molécula receptora ha ocurrido, las células T y B son capaces de responder a su antígeno e inducir una respuesta inmune. Sin embargo, la activación celular está finamente regulada para asegurar que sólo antígenos dañinos desencadenen la reacción o respuesta. Tal regulación particularmente tiene que ver con la iniciación de la activación de los linfocitos T. Ello requiere que el antígeno sea presentado a la célula T asociado a una molécula MHC propia. Esto es debido a que el TCR no reconoce el epitopo antigénico en forma soluble, sino que reconoce el complejo formado por el péptido antigénico asociado a la molécula MHC II propia.
Las células T vírgenes presentan receptores (adresinas nodulares periféricas) que se unen a moléculas de adhesión presentes en vénulas de endotelio alto de linfonodos; entran, así, en los nódulos y los recorren, uniéndose transitoriamente a múltiples células presentadoras de antígenos. Aunque alrededor del 95% de los linfocitos T están secuestrados dentro de los tejidos linfoides, ellos no están estáticos, sino que se mueven continuamente de un tejido linfoide a otro a través de la sangre o la linfa, viajando por todo el cuerpo en uno o dos días. El tráfico de linfocitos es considerable, la salida de linfocitos desde los vasos linfáticos eferentes es de 3 x 107 células/gr de tejido linfoide. Por lo tanto, en poco tiempo una célula T se encuentra con su antígeno. Cuando una célula T se encuentra con una APC que lleva unido el antígeno, la activación ocurre en 2 a 3 días.
El antígeno es llevado al tejido linfoide directamente en los linfáticos o dentro de una célula dendrítica (u otra célula APC) que ha endocitado el antígeno. Si hay una inflamación en un tejido, las células dendríticas pueden dejar ese sitio y migrar al linfonodo más cercano. Los antígenos en la sangre son llevados al bazo, los que están en los tejidos hacia los linfonodos y los que están en la mucosa, al tejido linfoide asociado a las mucosas. Las células dendríticas expresan receptores para quimioquinas linfoides y migran hacia el tejido linfoide que expresa estas últimas constitutivamente. Las células dendríticas son, pues, muy importantes en la activación de células T vírgenes primarias. Claro, los antígenos son procesados por las células APC (macrófagos, células dendríticas interdigitantes y células B), quedando listas para atraer células T específicas del antígeno en cuestión e inducir, así, una respuesta inmune.
Pero ¿cómo es que el antígeno se une a la molécula MHC? Hay dos formas. El antígeno puede haber sido producido endógenamente dentro de la célula (en el caso de proteínas virales o neoplásicas) y es acomplejado con moléculas MHC clase I a través de un procesamiento intracelular. Por ortro lado, células APC profesionales especializadas (células dendríticas, células de Langerhans, células B y macrófagos) pueden internalizar un antígeno exógeno por endocitosis. Este antígeno exógeno es procesado de un modo diferente al endógeno y re-expresado en la superficie celular acomplejado a una molécula MHC clase II. La molécula MHC clase II presenta una expresión restringida en condiciones normales sólo en estas células especializadas.
Las células T citotóxicas (CD8+) hacen su trabajo liberando linfotoxinas, las que causan la lisis celular. Las células T helper (CD4+) sirven como coordinadores, directores de la respuesta inmune, reconociendo antígenos foráneos. Ellos pueden secretar substancias químicas conocidas como linfoquinas que estimulan a las células citotóxicas y a las células B para crecer y dividirse, atraer neutrófilos y estimular la capacidad de los macrófagos para engullir y destruir microorganismos. Las células T supresoras inhiben la producción de células T citotóxicas una vez que ellas ya no son necesarias. Las células T memoria (CD45RO) están programadas para reconocer y responder a los patógenos una vez que ellos ya han invadido y han sido repelidos previamente, pueden vivir por 10 años, reaccionan más rápidamente a exposiciones ulteriores debido a que su ciclo celular es más corto (12 h comparado con 24 h).
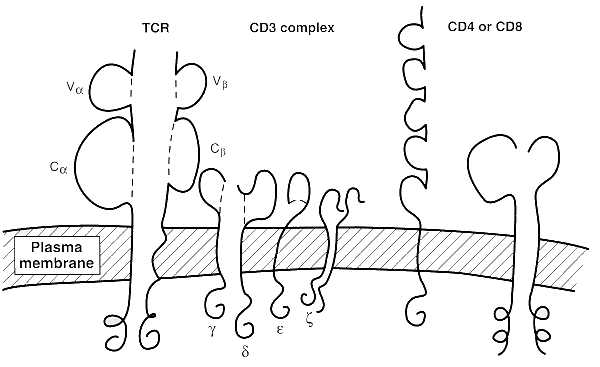
Figura 8: Receptor de célula T (TCR), complejo
CD3 y moléculas CD4 y CD8 de linfocitos T.
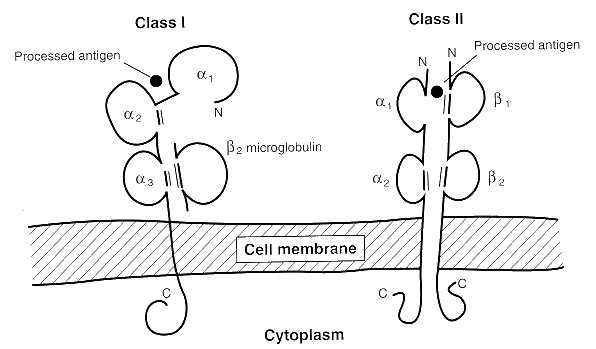
Figura 9: Complejo mayor de histocompatibilidad (MHC)
clase I y II.
La necesidad de un procesamiento intracelular y la expresión de moléculas MHC asegura que sólo antígenos derivados de moléculas foráneas que han invadido el interior de una célula del hospedero o que han inducido una respuesta inflamatoria que active la endocitosis de células APC, pueden ser reconocidos como extraños. Otra forma de impedir una presentación antigénica inadecuada se explica porque la unión del TCR al complejo antígeno-MHC por sí misma no es suficiente para inducir la activación de la célula: se requiere además una estimulación por correceptores. Los correceptores son moléculas de la superficie de células T que envían señales hacia el interior de la célula para activarla una vez que el TCR ya se ha unido a su ligando. Sin estas coseñales la célula se volverá anérgica (no reactiva) o morirá por apoptosis.
Los linfocitos CD4 se subdividen funcionalmente por el patrón de citoquinas que producen. Cuando son estimuladas los linfocitos Th0 se convierten en células Th1 o Th2. La diferencia entre ellas sólo reside en las citoquinas que secretan, pues morfológicamente son indistinguibles. Sin embargo, la respuesta que ellas generan es muy diferente. Las células Th1 producen IL-2 que induce la proliferación de células T (incluyendo a las CD4+ de un modo autocrino). La IL-2 estimula la división de células T CD8+ y la citotoxicidad al disminuir los umbrales de activación. La otra citoquina producida por los linfocitos Th1 es el interferón g, que activa a los macrófagos para que destruyan patógenos intracelulares tales como micobacterias, hongos o protozoos e induce la citotoxicidad de las natural killers. Su importancia se ha visto en aquellos pacientes que no presentan receptores para interferón g, quienes sufren severas infecciones micobacterianas. Las citoquinas de las Th1, por tanto, inducen principalmente respuestas inflamatorias mediadas por células, como, por ejemplo, las lesiones granulomatosas de la tuberculosis. Hay un feedback positivo del interferón g que estimula a otras células Th0 para que se conviertan en Th1 e inhibe la diferenciación a células Th2. La interlequina 12 secretada por macrófagos estimulados por interferón g aumenta la producción de interferón g por las células T. Una respuesta Th1 es esencial para que el hospedero pueda controlar la replicación de patógenos intracelulares, pero posiblemente contribuya a la patogénesis de enfermedades autoinmunes como la artritis reumatoídea o la esclerosis múltiple. Análogamente, las células Th2 producen interleuquinas 4, 5, 6 y 10 que favorecen la producción de anticuerpos. La IL-4 induce el cambio de clase (switching de isotipo) en las células B hacia la producción de IgE y la IL-5 promueve el crecimiento de eosinófilos. La IL-4 provee un feedback positivo para inducir respuestas Th2 y suprimir la diferenciación hacia células Th1. De este modo la respuesta Th2 está asociada con enfermedades alérgicas.
Las células T citotóxicas destruyen
aquellas células que presentan antígenos en superficie. Después
de unirse a la célula diana, las células T CD8+ insertan
perforinas a la membrana celular, del mismo modo como lo hacen las células
natural killers. Gránulos citoplasmáticos que contienen granzimas
pasan a través de los poros desde las células T hacia el
citoplasma diana. Se activan, así, caspasas que inducen la fragmentación
del ADN y la apoptosis celular. Las células T citotóxicas
también pueden unirse a moléculas Fas de la superficie de
las células diana gracias a sus moléculas Fas ligando (FasL),
lo que también activa la apoptosis. Del mismo modo como se diferencian
las células Th0 a Th1 y Th2, las células T citotóxicas
0 se diferencian a T citotóxicas 1 y 2, según la secreción
de citoquinas que presenten. Estos subtipos celulares presentan un repertorio
de citoquinas limitado y su rol aún no está claro. También
se ha postulado que algunas células T CD8+ tienen una función
supresora al "downregular" (regular hacia abajo) algunas respuestas de
los linfocitos.
Inmunidad humoral
Un linfocito B inmunocompetente pero aún inmaduro es estimulado a madurar cuando un antígeno se une a sus receptores de superficie y hay una célula T helper cerca (para liberar citoquinas). Esto sensibiliza a las células B y experimentan una selección clonal lo que significa que se multiplica por mitosis. La mayor parte de los clones de la familia llegan a ser células plasmáticas. Estas células después de un descanso inicial producen anticuerpos altamente específicos a una tasa de alrededor de 2000 moléculas por segundo por cuatro a cinco días. Las otras células B sensibilizadas se transforman en células memoria de larga vida.
Los anticuerpos, también llamados inmunoglobulinas (Ig), constituyen la porción gamaglobulina de las proteínas sanguíneas. Ellas son proteínas solubles secretadas por clones de células plasmáticas activadas. Los anticuerpos inactivan antígenos por: a) fijación del complemento (proteínas se unen a antígenos de superficie, causando que se active cascada enzimática que lleva a la lisis celular); b) neutralización (unión a sitios específicos para impedir su adhesión); c) aglutinación; d) precipitación (forzando la insolubilidad); e) opsonización y f) sensibilización de células tumorales e infectadas a una citotoxicidad dependiente de anticuerpos. Aunque el anticuerpo es un producto de secreción de células B activadas con las funciones ya mencionadas, durante las primeras etapas de desarrollo de la célula B es una molécula de membrana que actúa como un receptor de célula B. Su rol es internalizar el antígeno y procesarlo para que la célula B se comporte como una APC.
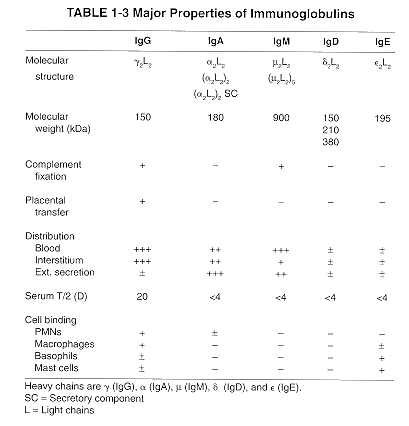
Tabla III: Propiedades de las inmunoglobulinas.
El tejido linfoide asociado a mucosa consiste consiste en tejido linfoide en varios sitios mucosos (bronquios, intestino, tracto urogenital). Sin embargo, todos ellos están relacionados funcionalmente a subpoblaciones de células B que regresan a estos tejidos específicamente. Así, una respuesta generada en un sitio inducirá respuestas inmunes al mismo antígeno en otros sitios. Este efecto puede usarse terapéuticamente porque la vacunación en un sitio mucoso puede potencialmente inducir una inmunidad mucosa generalizada. Por ejemplo, una vacuna oral podría inducir inmunidad vaginal y rectal que puede ser particularmente relevante en infecciones como el VIH.
La mayor parte de las células B permanece en el tejido linfoide, siendo pequeña la porción celular que recircula. Las células B normalmente reconocen antígenos libres (solubles) que llegan a tejidos linfoides por rutas antes descritas. Sin embargo, durante infecciones subsecuentes por el mismo patógeno, las células B pueden ser activadas por células dendríticas foliculares que posean receptores Fc o del complemento, unen complejos que tienen antígenos y se activa la respuesta de células B (las células dendríticas foliculares son una familia diferente del resto de células dendríticas y no endocitan ni presentan antígenos).
Debe destacarse el grado de flexibilidad que presentan
las moléculas de inmunoglobulinas. Esta libertad de movimiento permite
una más fácil conformación a las porciones más
inaccesibles del antígeno. La porción superior o Fab (antigen
binding) de la molécula de anticuerpo se une (física y no
necesariamente químicamente) a proteínas específicas
(llamadas epitopos) del antígeno. Así, el anticuerpo reconoce
al epitopo y no al antígeno completo. La región Fc es cristalizable
y es responsable del isotipo de la inmunoglobulina y de las funciones efectoras
(Figura 10).
.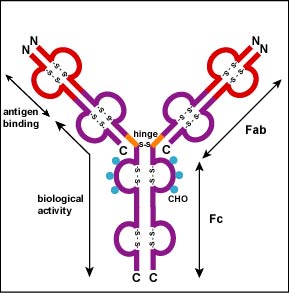
Figura 10: Estructura y dominios de molécula de inmunoglobulina.
Los antígenos reconocidos por la IgM (receptor) de superficie de las células B es internalizado, procesado y re-expresado acomplejado a la molécula MHC clase II de la célula B. Esta puede, entonces, presentar el antígeno a una célula Tsensibilizada específica (que reconoce diferentes partes del mismo antígeno). La célula T, por su parte, produce citoquinas (factor de crecimiento de células B) que llevan a la división celular y a la maduración a célula secretora de anticuerpos. Interacciones posteriores de la célula T, particularmente la unión del CD40 de la célula B con el ligando del CD40 de la célula T induce el switching de isotipo (Figura 11) desde la respuesta IgM inicial (hacia otro isotipo de inmunoglobulina). Sin embargo, como el gen VDJ (ver más adelante y figura 13) no es alterado posteriormente, el mismo sitio de unión al antígeno es el que se sigue utilizando (manteniéndose la especificidad, por lo tanto). Así, una célula B madura, pero virgen, que ha reordenado su gen VDJ, inicialmente tendrá una respuesta IgM a la estimulación antigénica primaria porque esta es la primera cadena pesada en ser translocada. La IgG y otras respuestas isotípicas se desarrollarán posteriormente y requerirán ayuda de células T. El proceso de activación de células B ocurre principalmente en los centros germinales de los linfonodos. En este sitio se produce una hipermutación somática (en aquellos segmentos de la cadena del anticuerpo que se unirán al antígeno) que es responsable de una mayor especificidad (maduración de la afinidad). Aquellas células cuyos anticuerpos de superficie unen antígenos más ávidamente proliferan más eficientemente y, por tanto, la respuesta del anticuerpo madura con mayor afinidad. Una vez que se produce el switch desde IgM hacia otro isotipo algunas células activadas se convierten en células memoria. Estas reaccionan rápidamente a una segunda exposición antigénica y se produce una producción característica de IgG en esta respuesta secundaria (Figura 12). Las células B activadas dejan el tejido linfoide como plasmocitos. El bazo tiene un rol particular en la respuesta contra polisacáridos bacterianos (cápsula), especialmente en la producción del anticuerpo de subclase IgG2, que es importante en la protección contra pneumococos, haemophilus y meningococos. Las células B de la zona marginal en el bazo son importantes en este proceso. Tanto es así, que el bajo número de ellas en la infancia y su remoción tras una esplecnotomía se correlaciona con una respuesta pobre de anticuerpos frente a los microorganismos mencionados.
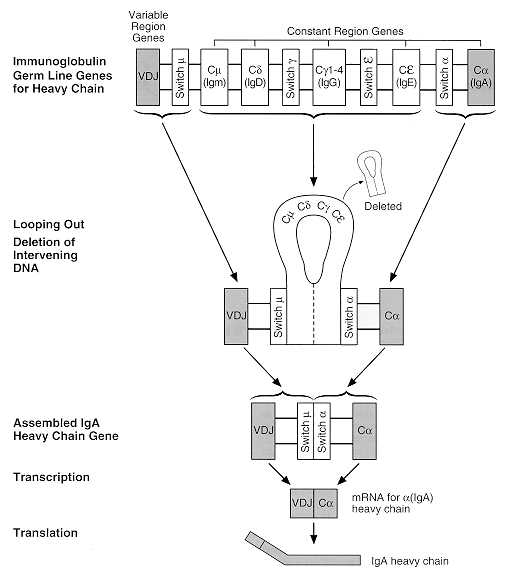
Figura 11: Switch (cambio) de isotipo de la cadena de inmunoglobulina.
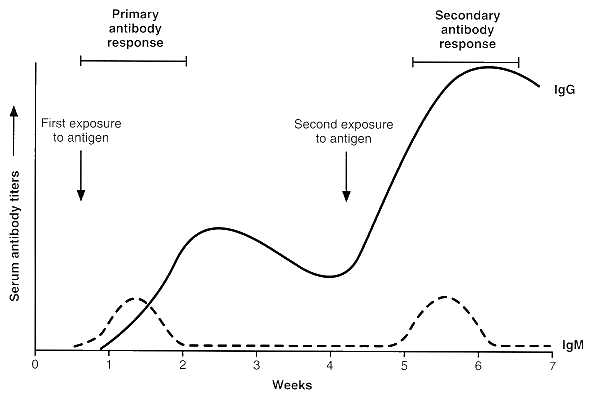
Figura 12: Títulos séricos de anticuerpos
frente a exposiciones antigénicas primarias y secundarias.
Un punto interesante, ya esbozado, es que las células B pueden producir 1010 formas conformacionales diferentes de anticuerpos, lo que les entrega una gran capacidad de potenciales especificidades antigénicas.
El proceso de reordenamiento del receptor de célula B es similar al de los TCR. Hay cuatro segmentos de genes involucrados en la formación del receptor, llamados regiones variable (V), de la diversidad (D), de unión (J) y constante (C). Estas se encuentran en diferentes cromosomas de la célula en desarrollo. Los segmentos cromosómicos son cortados por nucleasas y reunidos (spliced) usando ligasas. Así se forma la secuencia génica final a partir de la cual la proteína será transcrita para formar la molécula receptora. Hay varias formas como ocurre la diversidad clonal. Primero, hay una multiplicidad de regiones dentro de la cadena de DNA (V= 25-100 genes, D~ 25 genes, J~ 50 genes), pero sólo una de estas es ocupada. Hay, además una libertad combinatoria de cada una de estas regiones, de modo que uno de estos genes puede unirse con cualquier otro para formar la región VDJ final (Figura 13). Segundo, el splicing es inexacto y el ordenamiento de pares de bases lleva a que se produzcan aminoácidos diferentes (diversidad de unión). Tercero, la enzima desoxirribonucleotidiltransferasa puede insertar nucelótidos que alteren la secuencia. Un gran repertorio del receptor de célula B se produce, además, por un reordenamiento génico de la inmunoglobulina que ocurre durante la división de la célula B después de la estimulación antigénica (hipermutación somática), lo que permite una "maduración de la afinidad", es decir, que ante una segunda exposición antigénica, la unión antígeno-anticuerpo será más rápida, más específica y más fuerte. Pero ¿cuál es el receptor de la célula B? Es una forma de IgM unida a membrana, que inicialmente se expresa sola, pero posteriormente lo hace con IgD.
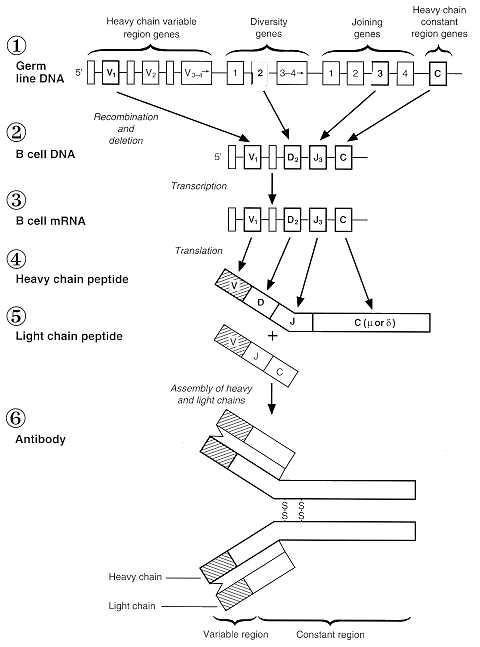
Figura 13: Reordenamiento y ensamblaje de cadenas
livianas y pesadas de molécula de anticuerpo.
La creación de nuevos clones de células T y B continúa a lo largo de la vida, después de los 20 años, lo que significa que tales individuos reconstituyen más lentamente su sistema inmune después de un transplante de médula ósea o luego de ser tratados con terapia antirretroviral en caso de infección por VIH.
Todos los mecanismos usados por los anticuerpos pueden ser utilizados para unirse a los antígenos y receptores celulares. Puesto que hay muchas formas de receptores disponibles, los leucocitos deben optimizar el grado de confluencia entre dos receptores. El número de estos mejores receptores con una mejor unión puede ser muy pequeño, tanto como uno solo. Ello da cuenta de la especificidad de la interacción. No obstante, las células pueden unirse a receptores cuyas uniones son menos óptimas que las requeridas. Esto puede llevar a una reactividad cruzada. Pero esta reactividad cruzada tiene sus límites. Hay muchos receptores a los que los viriones no pueden unirse. Muy pocos virus pueden unirse a células cutáneas.
Por otro lado el proceso de producción aleatoria
de receptores antigénicos inevitablemente conduce al desarrollo
de receptores autorreactivos que se unen a antígenos propios. Sin
embargo, hay mecanismos para inducir la tolerancia (estado en el cual el
sistema inmune no responde a un antígeno) y reducir el riesgo de
enfermedades autoinmunes. En primer lugar, la unión de un antígeno
específico a un receptor de célula T o B en linfocitos inmaduros
(dentro del timo o de la médula ósea) los lleva a la muerte
celular programada (apoptosis) y deleción clonal. Esto es debido
a la falta de activación por moléculas coestimuladoras o
porque estas no se expresen o por la baja concentración de citoquinas.
Sobre el 90% de los timocitos mueren por apoptosis (ya sea porque no son
seleccionados positivamente o debido a que son autorreactivos y, por tanto,
seleccionados negativamente), aumentando el grado de regulación
que ocurre durante el procesamiento tímico. Sin embargo, habrá
algunos antígenos que no se expresen en los tejidos linfoides primarios,
pero que serán detectados en la periferia. Una exposición
antigénica en estas circunstancias induce en la células autorreactivas
la anergia (falta de respuesta). Esto, nuevamente, es el resultado de la
falta de moléculas coestimulatorias al no haber daño tisular.
La tolerancia de células T se esperaría que redujera las
oportunidades de células B de reaccionar contra autoantígenos,
además de la deleción clonal de células autorreactivas
en la médula. Sin embargo, hay quienes postulan mecanismos adicionales
para prevenir la autoinmunidad en las células B. Las células
que inadvertidamente producen anticuerpos autorreactivos debieran ser capaces
de editar la especificidad de su receptor. Anticuerpos anti-idiotipo que
se unen al idiotipo (sitio de unión al antígeno) de las células
B pueden también suprimir la producción de anticuerpos.