UNIVERSIDAD MAYOR
FACULTAD DE ODONTOLOGIA
UNIDADES DE AUTO
– APRENDIZAJE
|
TEMA |
BIOQUIMICA
DE LAS CARIES |
|
TIEMPO
APROXIMADO |
45 MINUTOS |
|
AUDIENCIA |
Alumnos CURSO
CARIOLOGIA |
|
INSTRUCTORES |
Gabriela
Bustos P. Alumna
3er año, Odontología, U Mayor. |
I. RACIONAL.
La
comprensión de la composición y formación desde el punto de vista bioquímico de
la caries, permite al odontólogo tener una visión mas especifica del proceso de
la caries, y los mecanismos moleculares que están involucrados y así, de esta
forma, poder hacer mejor uso de los recursos odontológicos para su prevención y
tratamiento.
II. OBJETIVOS
TERMINALES.
El
alumno será capaz de tener conocimiento sobre la composición bioquímica del
diente, sus etapas de formación y los distintos factores que pueden incidir en
ella, relacionándolo con los factores que predisponen a la aparición de caries
en el individuo y la evolución a nivel molecular de esta.
III. OBJETIVOS
ESPECIFICOS.
El
alumno estará capacitado para:
– Tener conocimiento sobre la composición
molecular del esmalte y dentina.
– Poseer conocimiento de la formación del
esmalte desde un punto de vista bioquímico, y como afecta en la predisposición
a la caries.
– Adquirirá conocimientos de las propiedades
bioquímicas de los tejidos que componen el diente y su implicancia en el
proceso de la caries.
– Obtendrá conocimientos específicos
sobre el desarrollo a nivel molecular de la caries en tejidos como el esmalte y
la dentina.
– Logrará aplicar los conocimientos
aprendidos en la prevención y tratamiento de la caries en pacientes.
![]()
Ciclo de Practica I
ESMALTE
1. Amelogénesis:
Consta de varios pasos que incluyen las etapas secretoras, de transición
y de maduración. Esta última son ciclos repetitivos donde los ameloblastos van
cambiando su forma y se va produciendo la elongación de los cristales del
esmalte.
En la etapa secretora, los ameloblastos que se ubican en forma de
columna, adyacentes a la formación del esmalte, van a secretar la matriz de
proteínas especializadas, en conjunto con los iones necesarios para que ocurra
la precipitación y la formación de los cristales del esmalte, el cual al ir creciendo
va corriendo a los ameloblastos hacia la periferia.
Las proteínas de largo completo se ubican en el frente de
mineralización, sugiriendo que estas participan en la elongación de los
cristales. También existen proteínas que se ubican además de en el frente, en
los costados, dirigiendo el crecimiento ordenado de los cristales otorgándoles
así, su forma característica.

1.
Fig.1
Fotografía de microscopía electrónica de barrido, en donde se ve la forma de
los cristales de hidroxiapatita, uno al lado del otro, en forma ordenada. Entre
medio deberían ir las proteínas que dirigen su crecimiento ordenado. (Montoya M. Clases teóricas. Curso Cariología 2008, Fac.
Odontología, U. Mayor.)
Una vez que los cristales ya se forman y como parte del proceso de
formación del esmalte, está la degradación de este componente orgánico, es
decir, las proteínas, y el relleno del espacio que dejan con cristales.
Entonces:
En la etapa secretora, se deposita casi el 100% de las proteínas y
empieza la deposición del contenido mineral.
En la etapa de transición está la formación de la lámina basal.
En la etapa de maduración se empiezan a perder las proteínas y aumenta
hasta el 100% el contenido mineral. Esto no significa que el esmalte sea 100%
mineral, sino que del porcentaje mineral, en esta etapa se deposita el total.
El componente proteico, la mayor parte es degradación de proteína, pequeños
péptidos que van quedando entremedio y también a veces proteínas enteras. Esto
es importante para después ver la formación de las caries en esmalte.
Después de la amelogenesis entonces, vemos los cristales ordenados y
espacios entre ellos. El esmalte no es 100% sellado, posee microporos por donde
pasan iones tales como protones de muy pequeño tamaño.
Durante los procesos en donde los ameloblastos sufren ciclos de
modulación, los bordes quedan lisos sellándose completamente, sin permitir el
intercambio de iones, quedando el pH cerca del fisiológico, o toman forma como
bordes en cepillo, en donde hay un intercambio de iones con el medio externo,
bajando el pH celular.
En un ciclo entonces comienza el depósito y el crecimiento de los
cristales en forma exponencial. Durante la etapa de formación del cristal se
van formando protones y los ameloblastos para compensar esa ganancia de
protones o perdida de pH, recurre al sistema Bicarbonato, el cual a través de
anhidrasas carbónicas especificas, toman los protones y los secretan en forma
de bicarbonato hacia el medio. Esto es para tamponar el medio interno, ya que
en concentraciones altas de protones se impide el crecimiento de los cristales.
Por esta situación de liberación de protones en algunos casos el
carbonato es capaz de reemplazar a algunos fosfatos del cristal de hidroxiapatita,
quedando este cristal más inestable, más soluble.
Otra situación que ocurre asociada a la formación de los cristales es la
llegada de Sodio y Magnesio. El problema que esto conlleva es que el Sodio y el
Magnesio son capaces de reemplazar al Calcio en los cristales de
hidroxiapatita, haciéndolo más inestable, por ende mas soluble. Esto es
importante en la formación de la Caries, ya que estos componentes son normales
en la formación del esmalte, pudiendo alterar la calidad del esmalte, teniendo
así zonas con diferente solubilidad de esmalte.
Se sigue hasta última hora en la etapa de maduración sintetizando
proteínas nuevas, la función de estas proteínas no se conoce muy bien, pero van
a formar parte del esmalte. Esto es importante, ya que aquellas zonas donde hay
mayor contenido proteico, es más fácil la degradación en caso de haber caries,
ya que estas zonas no son completamente selladas.
El ameloblasto va secretando iones para formar el precursor del cristal
de hidroxiapatita, el que va poco a poco creciendo hasta formar el prisma de
hidroxiapatita. Todo esto dirigido por las proteínas que tienen que degradarse
en el momento adecuado. Entonces las proteasas logran el alineamiento y
formación de la estructura, y se van degradando con el tiempo.
La calidad del esmalte que se forma finalmente, va a depender de cada
persona.
El 80-90% de los cristales son de Hidroxiapatita de calcio carbonatado.
El 10-20% restante corresponde a fluidos y material orgánico, que quedan
entremedio de los cristales.
2. Estructura:
Es uno de los tejidos más duros del organismo incluso más duro que los
huesos, es acelular y está compuesto por una fase inorgánica (95%), que constituye los
cristales de hidroxiapatita, estos cristales de OH apatita también se
encuentran en dentina y cemento, pero en el esmalte son más grandes y largos
con 50 nm de diámetro al corte transversal y 100 um de longitud.
El
cristal de OH apatita esta constituido por estructuras repetidas de calcio,
fosfatos e hidroxilos, cuya fórmula es (Ca10(PO4)6(OH)2),
estos iones se alinean para formar cristales hexagonales, que a su vez se van a
empaquetar densamente constituyendo un prisma o varilla del esmalte.
El otro
5% es la fase orgánica está constituido por agua y proteínas (amelogenina,
ameloblastina, enamelina, etc), las cuales en el esmalte maduro pasan a ser
residuos de proteínas que van quedando en el esmalte.
Esta es la composición general del esmalte, donde desde la superficie
externa hasta la unión amelodentinaria la proporción de mineral es mayor en la
parte externa que en la parte interna del esmalte. El componente orgánico,
además, va aumentando hacia la unión amelodentinaria. Por eso mismo la densidad
es distinta en sus diferentes porciones, siendo mayor hacia la capa externa que
en la interna, por la existencia de mayor contenido orgánico en esta ultima y
de fluidos.
La
superficie del esmalte esta rodeado por una película que esta constituida por
la absorción selectiva de proteínas desde la saliva a la superficie del
esmalte, las cuales influyen en las propiedades físico químicas porque
constituyen una barrera que impide la perdida de minerales y también la
remineralización porque impide también la entrada hacia el esmalte.
3. Cristal de OH apatita:
Constituido
por un núcleo central que es el Hidroxilo con fosfatos distribuidos con una
anulación de 60º unos de otros formando un triangulo alrededor del hidroxilo.
Formando otro triangulo tenemos a los iones calcio que también van a estar
orientados a 60º unos de otros. Y finalmente toda la estructura está rodeada
por una red hexagonal constituida por iones calcio que le da la forma de
hexágono a la OH apatita.

Fig.2. Estructura del cristal de
hidroxiapatita
(http://dopamine.chem.umn.edu/chempedia/index.php/Toothpaste)

2.
Fig.3. Microscopía
electrónica de transmisión donde se observan los cristalitos del esmalte que
están organizados y empaquetados. (Hernández M. Clases teóricas. Curso
Cariología 2006, Fac. Odontología, U. Mayor.)
Entre
los cristales y entre los prismas es donde se concentra la mayor cantidad de
agua y sustancia orgánica, como también la menor concentración de iones.
Estos
iones no se distribuyen en forma pareja, siendo más concentrados en la
superficie y menos concentrado en la
profundidad del esmalte, puntos y fisuras.
Retroalimentación:
1-.
Nombre los componentes del esmalte y su distribución:
2.-
Nombre iones que reemplazan a los componentes del cristal:
Referencias Bibliográficas:
3.
Montoya M. Clases teóricas. Curso Cariología 2008, Fac.
Odontología, U. Mayor.
4. T.A.
Mitsiadis y T. Rahiotis. Parabellls between tooth development and
repair: Conserved molecular mechanisms following carious and Dental injury. J
Dent Res 83(12):896-902, 2004.
5. J. Arends and J. Chiristoffersen. The Nature of Early
Caries Lesions in Enamel. J Dent Res 65(1):2-11, January, 1986.
![]() Ciclo de Practica II
Ciclo de Practica II
PROPIEDADES
DEL ESMALTE
1. Propiedades Físicas.
Las
propiedades físicas del esmalte van a estar dadas por los cristales de
hidroxiapatita, por lo tanto sus propiedades deberían ser similares. Sin
embargo como el esmalte esta constituido por cristales que no son tan perfectos
y que tiene reemplazados algunos de sus
iones, sus propiedades físicas son levemente menores a las del cristal de
hidroxiapatita pura.
Color:
La hidroxiapatita tiene un índice de refracción (IR) de 1.64 lo que le da
un aspecto completamente transparente. En cambio el esmalte tiene un IR de
Dureza:
Se da por el grado de cohesividad entre los cristales, teniendo la
hidroxiapatita una dureza de 430 HKN y el esmalte de 370 HKN.
Solubilidad:
La de la hidroxiapatita es menor que la del esmalte. Siendo la de la
hidroxiapatita
2. Solubilidad y disolución de la Hidroxiapatita (OHA):
![]() Ca3
(PO4)3 (OH) 5Ca 2+ +
3PO43- +
OH
Ca3
(PO4)3 (OH) 5Ca 2+ +
3PO43- +
OH
En
soluciones acuosas las sales tienden a disolverse debido a la constante
dieléctrica del agua. El agua tiende entonces a hacer que se liberen iones de
la red y tiende a rodearlos e hidratarlos. Si nosotros colocamos OH apatita en
agua va a tender a solubilizarse y va a liberar 5 iones de calcio, 3 fosfatos y
un hidroxilo. Inicialmente la liberación de estos iones va a ser rápida pero
llega un punto en que hay un equilibrio donde la disolución se define y hay un
cambio mutuo entre los iones de la solución y el cristal.
Cuando
hablamos de equilibrio significa que la solución esta saturada para este
cristal, es ese caso el Producto de solubilidad (KSP) va a ser igual al de la
actividad iónica (IAP) de la hidroxiapatita que es la que tiende a mantener al
cristal integro y el KSP disolverlo.
Por lo
tanto si:
·
KSP es mayor a IAP es una solución insaturada, y por lo
tanto va a haber una disolución de los cristales de hidroxiapatita
·
KSP es menor a IAP la solución esta sobresaturada y va
atender una precipitación y reformación de los cristales.
Además
el grado de solubilidad esta determinado por otros 2 factores:
Temperatura:
Si
consideramos una sal como el cloruro de sodio por ejemplo, cuando aumentamos la temperatura
tiende a ser más soluble, pero con la OHA es todo lo contrario, cuando
disminuye la temperatura aumenta la solubilidad. O sea al tomar una bebida
caliente hay menos posibilidad de disolución del esmalte que una bebida fría.
pH:
El
cloruro de sodio no es muy influenciable con los cambios de pH, pero para la
OHA es crítico. Cuando hay una solución saturada, al bajar el pH iones
hidroxilos y fosfatos van a tender a formar ácidos en presencia de los protones
perdiéndose iones fosfatos e hidroxilos quedando la solución subsaturada
respecto al cristal, esto va a provocar una disolución del cristal a la
solución. Por lo tanto la baja de pH promueve la salida de iones.
Existe
también el pH critico, que es cuando una solución que esta sobresaturada, se
convierte en saturada, y por lo tanto es el punto limite donde la solución si
baja un poco de pH se encuentre subsaturada y comience a disolver el cristal.
En la
Fig.1 esta de nuevo otra explicación de cómo el pH actúa en la disolución de la
OHA, la cual a pH ácido o cuando baja el pH se disuelve porque las soluciones
que lo rodean se vuelven insaturadas (saliva, fluido de la placa bacteriana,
etc.)
La
disolución va a depender entonces del grado de instauración, o sea mientras más
bajo el pH más disolución de la OHA.

Fig.1 Grafico solubilidad v/s pH. Se observa el pH que
varia de 4 a 8 ya que el fisiológico va hasta los 7.4. Como vemos hasta el pH
5.5 la solubilidad es nula incluso hay una tendencia a la precipitación, pero
del %. En adelante vemos como asciende la
solubilidad de la OHA, por lo tanto el pH critico en
función de la OHA esta en 5.5. (Tomado de Fejerskov O.,Kidd EAM. Dental Caries. Ed. Blackwell. 2003.
Ch.4, p.57)
Si
adicionamos cualquier ion va atender a disminuir la solubilidad o detenerla, o
sea no necesitamos agregar los tres iones, basta q agreguemos o calcio o
hidroxilo o fosfatos para poder detener.
3. Precipitación de la OH apatita:
Cuando
la solución esta sobresaturada tenemos el fenómeno de la precipitación y además
los cristales más pequeños o más mal formados van a tender a crecer, por lo
tanto hay una recuperación de zonas donde había iones perdidos (carbonato o
magnesio) y en general va a haber mayor estabilidad.
¿Cómo podemos sobresaturar la solución?
-
una forma obvia es agregar los iones que componen el
esmalte, entonces agregamos calcio y fósforo.
-
Si elevo el pH se van a liberar esos iones que estaban
formando ácido, entonces la solución va a quedar sobresaturada.
Pero
este proceso de precipitación no es definido y no ocurre tanto porque hay
efectos inhibidores como la saliva actúa como buffer y por otro lado evita la
precipitación de sales de calcio por ejemplo en la salida de conductos. Dentro
de estos inhibidores destacan algunas proteínas como albúmina y pirofosfatos.
Además el cristal no puede crecer eternamente. Tiene restricciones inherentes,
ya que dentro del tejido dentario solo va a crecer un par de manómetros en
esmalte y dentina donde es más pequeña aun. También tiene restricciones
físicas, ya que están tan estrechamente empaquetados los cristales que es
imposible que haya espacio suficiente para que sigan creciendo, solo lo hacen
en relación al espacio que hay.
4. Estabilidad de la OHA:
Hay
varios fosfatos de calcio formando los tejidos mineralizados en estructuras
orgánicas. Sin embargo al pH en que ocurren en la boca (normal) la OHA es lejos
la estructura más estable.

Fig.2.Grafico que muestra que el pH que
oscila entre 3 y 8 y acá la concentración de calcio requerida. Entonces vemos
que a pH normal la OHA de calcio es la más estable de todas porque requiere una
menor concentración de calcio en saliva para mantenerse estable. (Fejerskov O, Kidd EAM. Dental Caries. Ed.
Blackwell. 2003. Ch.4, p.53)
Otros
cristales como fosfato tricalcico, fosfato octocalcico y brushita son mas
inestables porque necesitan mas calcio para mantenerse en estado sobresaturado.
Esto ocurre a pH sobre 4.3 que supera con creces el pH normal de la boca, que
es lo que ocurriría al tomar bebidas muy ácidas, entonces a menor pH de 4.3
otros cristales son mas estables que la OHA, pero no es lo que ocurre a
condiciones fisiológicas.
5.
Sustituciones en el esmalte:
Como
sabemos hay iones extraños que sustituyen otros iones alterando las propiedades
del esmalte. Entonces podemos decir que la OHA es una fluorapatita carbonatada
porque hay un reemplazo del hidroxilo por fluor y fosfatos por carbonatos. Estos
iones extraños alteran la solubilidad, el carbonato y el magnesio tienen un
efecto sinérgico provocando un aumento de la solubilidad, por lo tanto tienen
un efecto perjudicial, en cambio el fluor va a provocar una disminución de la
solubilidad.
6. Fluidos orales:
En
general, en condiciones fisiológicas, para la OHA están sobresaturadas. En el
caso de la saliva no hay tendencia a estar precipitando constantemente
cristales por el efecto inhibitorio de las proteínas salivales.
En
cuanto al biofilm bacteriano esta más sobresaturado que la saliva, 2 a 4 veces
más y por lo tanto favorece la remineralización y va a tender a calcificarse la
placa bacteriana dando origen a la formación de cálculos, todo esto ocurre para
la OHA en relación a un pH critico que como sabemos es 5.5.
Con esto
podríamos pensar que la placa bacteriana es buena, sin embargo esta posee una actividad metabólica, entonces al
consumir azúcar, metaboliza la sacarosa originado Ácido láctico el cual baja el
pH del fluido produciendo una subsaturación y haciendo que salgan iones del
esmalte. (Fig.1)
La placa
bacteriana a su vez es un reservorio de calcio y fosfato, cuando ocurre una
disolución se va a liberar iones de la placa devolviendo los iones perdidos y
la sobresaturación del fluido.

Fig.3. Ciclo de la actividad de la placa
bacteriana. (Hernández M. Clases teóricas. Curso Cariología 2006, Fac.
Odontología, U. Mayor.)
 Estos son ciclos de
baja de pH, subsaturación, disolución, aumento de pH y precipitación. Si
nosotros tuviéramos una ingesta grosera de azúcar tendríamos este ciclo y no
habría problema. Sin embargo si tenemos ciclos repetidos de ingesta de sacarosa
va a llegar un momento en que el calcio y el fosfato que están en la placa
bacteriana se agotan y en el momento en que se produce la subsaturación no se
pueden reponer estos iones, entonces el esmalte se disuelve y se forma caries.
Por lo tanto tiene más riesgo cariogénico la ingesta repetida de azúcar que la
cantidad consumida en un solo momento.
Estos son ciclos de
baja de pH, subsaturación, disolución, aumento de pH y precipitación. Si
nosotros tuviéramos una ingesta grosera de azúcar tendríamos este ciclo y no
habría problema. Sin embargo si tenemos ciclos repetidos de ingesta de sacarosa
va a llegar un momento en que el calcio y el fosfato que están en la placa
bacteriana se agotan y en el momento en que se produce la subsaturación no se
pueden reponer estos iones, entonces el esmalte se disuelve y se forma caries.
Por lo tanto tiene más riesgo cariogénico la ingesta repetida de azúcar que la
cantidad consumida en un solo momento.
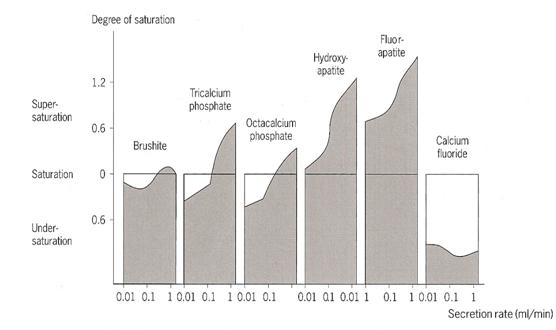
Fig.4. Gráfico con los grados de saturación
del medio salival, con los diferentes rangos de secreción salival. (O. Fejerskov y E.A.M. Kidd. Dental
Caries. Ed. Blackwell. 2003. Ch.4, p.53)
En la
Fig.4 vemos que la OHA y la fluorapatita están en un grado de sobresaturación,
que va a ser mayor cuando hay una mayor secreción salival. Sin embargo la
fluorapatita va a estar un poco más sobresaturada que la OHA. El fluoruro de
calcio se encuentra subsaturado.
Retroalimentación:
1.-
¿Cuál es la dureza del esmalte y de la OHA?
2.-
¿Cuál es el pH crítico?
Referencias
Bibliograficas:
1.
Montoya M. Clases teóricas. Curso Cariología 2008, Fac.
Odontología, U. Mayor.
2. J.M. Ten Cate. In situ models,
Physico-chemical aspects. Adv Dent Res 8(2): 125-133, July, 1994.
3.
Markku Larmas. Odontoblast function seen
as the response of dentinal tissue to dental caries. Adv. Dent. Res. 15:68-71,
August, 2001.
![]() Ciclo de Practica
III
Ciclo de Practica
III
CARIES
1. Desmineralización – Remineralización
La caries es un proceso que se puede
ver desde un punto de vista exclusivamente químico, porque es un balance de la
desmineralización v/s la remineralización del esmalte. Si la desmineralización
es mayor que la remineralización, tenemos un proceso de caries, en el cual los
cristales se van perdiendo hasta formar una cavidad. Si logramos tener una
remineralización mayor y mas rápida que la desmineralización, se logra reparar
el tejido y revertir el proceso de la formación de caries en el esmalte.
Entonces, estos dos procesos de
desmineralización y remineralización están en un balance continuo, producto de
los diferentes estímulos a los que está sometida la cavidad oral.
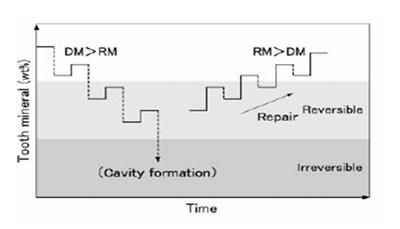
Fig.1. Ecuación de formación de la Hidroxiapatita.
Tenemos Calcio, Fosfato, agua y protones que salen.
(Tomado
de Oral Diseases (2004), 10:249)
En cualquier ecuación si uno coloca
más producto, la ecuación se va a inclinar hacia los sustratos. Y si pongo más sustrato,
la ecuación se va a ir hacia los productos.
A medida que hay más protones, la
reacción se va a ir hacia los sustratos, es decir hacia los componentes
solubles, hay disolución de los cristales.
Además, se pueden formar muchos
distintos cristales y estos se están formando y disolviendo y no todos son
iguales en calidad o insolubilidad que pueden llegar a ser. Entonces muchos de
los cristales que están entremedio no son hidroxiapatita sino una combinación
de varios tipos diferentes de cristales. Esta situación esta ocurriendo
constantemente en la superficie del esmalte.
Debemos
considerar que cada baja de pH en un punto va a provocar el aumento de la
solubilidad de apatita multiplicado por 10.
Cuando
hablamos de caries estamos hablando de la disolución del esmalte, pero la causa
es producida por ácidos orgánicos productos del metabolismo de azucares de bajo
peso molecular por la placa bacteriana
Pero
cuando hablamos de erosión también es la disolución del esmalte pero por ácidos
de otro origen, de cualquiera menos de la placa bacteriana, como por ejemplo el
grabado ácido.
2. Caries
Cuando
llegamos al pH crítico, o bajamos del pH crítico, ocurren dos situaciones:
-
La OHA esta subsaturada
-
La Fluorapatita esta sobresaturada porque es menos
soluble
La subsaturación
de la OHA va a provocar la disolución del esmalte subsuperficial constituyendo
el cuerpo de la lesión que presenta una pérdida de mineral del 30-50%.
Pero
como la fluorapatita esta sobresaturada, los niveles que se disuelven de la
profundidad van a provocar un aumento o supersaturación a nivel de los fluidos
provocando una precipitación de fluorapatita en la superficie del diente, pero
no es capaz de ingresar más profundo. Entonces se esta perdiendo OHA desde el
fondo de la lesión pero como la fluorapatita esta sobresaturada va a precipitar
quedando atacado solo en la superficie de la lesión.
El
efecto de esta capa superficial es ambivalente, por una parte protege el cuerpo
de la lesión que ha perdido mineral porque actúa como barrera y por esto mismo
va a impedir el ingreso de minerales como la fluorapatita hacia el interior del
diente impidiendo la remineralización.
3. Remineralización:
Para que
ocurra la remineralización se requiere de restos de cristales de OHA, se
necesita de un esqueleto de cristal para volver a remineralizar. Como ya hemos
visto también la solución debe estar supersaturada. Se necesita así mismo un
control de la PB para que esta no este provocando una baja de pH.
Va a ocurrir
siempre al interior de la capa superficial del esmalte o la mayor
remineralización. Raramente en el cuerpo de la lesión porque la capa
superficial actúa como barrera y también porque en el cuerpo de la lesión hay
una perdida total de minerales, y no hay restos para remineralizarlos.
Se cree
que cuando hay pérdida de la capa superficial, la fluorapatita si pasa al
cuerpo de la lesión, sin embargo en términos terapéuticos no se recomienda
sacar la capa superficial porque también quedan expuestos no solo a la
fluorapatita, sino también a ácidos.
En la
fig.2 se observa que donde hay una instauración de OHA y de fluorapatita a pH
muy bajos. Las caries por una baja de pH al critico hay una subsaturación de la
OHA pero una sobresaturación de la fluorapatita lo que determina la formación
de una capa superficial. Y cuando tenemos remineralización se encuentra sobre
el pH crítico.
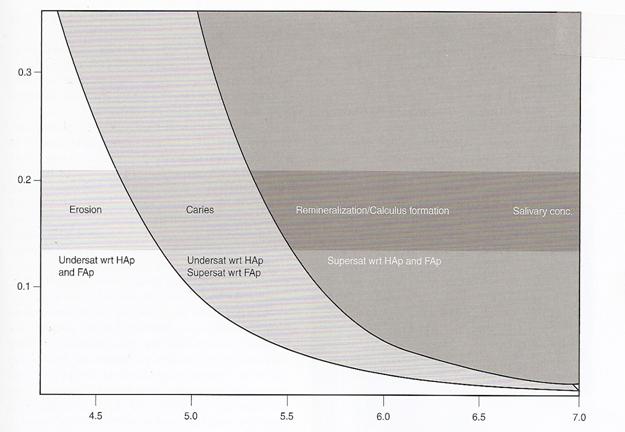
Fig.2. Condiciones de erosión.
. (O. Fejerskov y E.A.M. Kidd. Dental Caries. Ed. Blackwell. 2003. Ch.4,
p.53)
Retroalimentación:
1.- ¿Qué
debe ocurrir entre la desmineralización y remineralización para que exista
caries?
2.-
¿Para qué son necesarios los restos de cristales de hidroxiapatita?
Referencias Bibliográficas:
1.
Montoya M. Clases teóricas. Curso Cariología 2008, Fac.
Odontología, U. Mayor.
2. J.M. Ten Cate. In situ models, Physico-chemical aspects. Adv
Dent Res 8(2): 125-133, July, 1994.
3.
Markku Larmas. Odontoblast function seen
as the response of dentinal tissue to dental caries. Adv. Dent. Res. 15:68-71,
August, 2001.
![]() Ciclo de Practica IV
Ciclo de Practica IV
DENTINA
1. Dentina.
La
dentina está regida por las mismas reglas que el esmalte del punto de vista
químico. Pero hay factores que considerar.
Tiene un
75% de mineral con una OHA más pequeña, con un diámetro de 3 a 30nm y 50um de
longitud. Por lo tanto tiene una mayor superficie expuesta para intercambiar
iones.
Tiene un
25% de materia orgánica y agua constituido principalmente por colageno tipo I y
proteínas no colágenas como glicoproteínas, glucoproteínas, fosfolípidos,
proteoglicanos, fosfoproteínas, etc.
Estas
proteínas constituyen una red importante para mantener a la OHA en posición, de
manera que componente orgánico, principalmente el colágeno en la dentina tiene
un efecto sinérgico con la OHA. El colágeno mantiene a la OHA en posición y a
su vez no se requiere solamente de disolución del cristal, va a haber una
perdida de material orgánico para lo que se requiere proteinasa, estas
proteasas no tiene acceso a la red de colágeno si la OHA esta en posición, por
lo tanto se protegen mutuamente.
Adema
hay que considerar la presencia del complejo pulpodentinario donde este puede
responder porque es vital, lo que hace es ir colocando más mineral en el
interior del túbulo obliterándolo a veces. Y por otro lado existe un fluido en
los tubulos dentinarios, donde hay una gradiente de presión que va dirigido
hacia la superficie de la dentina y esmalte, por lo tanto los iones (protones)
tendrían que superar esta gradiente de presión para introducirse a la dentina.
2. Caries dentinaria:
Cuando
la dentina se expone a la cavidad oral por retracción gingival o por otros
factores, vamos a tener reordenamiento del mineral y una mayor susceptibilidad
a las caries porque la OHA es más imperfecta. Esto se comprueba en pacientes
con hiposialia que en esmalte no tienen caries, pero en la superficie dentinaria expuesta si.
3. Zonas de la Lesión.
La primera zona, es donde está el frente de avance de la lesión y se
llama zona traslucida. En esta zona hay una pérdida de mineral que va de un
1-2%. Está compuesto por un pequeño número de poros pero de bastante longitud.
Estos poros son los microporos por los cuales se desplazaban los protones entre
medio de los cristales, los cuales ahora al ir pasando van desmineralizándolos
y por lo tanto ampliándolos en longitud y diámetro.
Zona oscura o birrefringente. En esta zona la porosidad aumenta entre un
5 a 10%, pero aquí tenemos poros largos y poros pequeños. Los poros son más
pequeños porque hay depósito de material orgánico y proteínas en ellos.
Zona del Cuerpo de la Lesión, donde está la mayor pérdida de material
inorgánico. Existe un 25 a 50% de porosidad, por lo cual prácticamente los
cristales de hidroxiapatita están siendo degradados por todas partes. Los poros
se agrandan hasta que hay destrucción mecánica del diente o cavidad de la
caries.
Zona superficial, es la que esta en contacto con la placa. Esta es una
superficie relativamente intacta, existiendo una porosidad entre 1 a 2%.
Existen distintas hipótesis acerca del motivo por el cual esta zona esta
prácticamente intacta, siendo la más aceptada hoy en día la que postula que en
esta zona se produce una remineralización de los cristales producto de todos
los iones que se están solubilizando en las zonas mas profundas, los que
ejercen presión, en conjunto con los productos de la placa bacteriana y
constituyentes de la saliva.

Fig. 1. Se observa en (A) las zonas de la
lesión, en (B) concentraciones relativas de iones importantes, en (D) los
cambios de iones que ocurren en distintas zonas de la lesión y en (E) los
cambios que le ocurren a los cristales. (Crit
Rev Oral Biol Med (2000), 11:481)
En cuanto a la
concentración de iones (fig.1), esta es importante porque refleja el motivo por
el cual se forma la zona superficial, es que por ejemplo la cantidad de
fluoruros en la superficie es mucho más elevada que hacia la dentina.
Los
iones como el carbonato y el magnesio, que desestabilizaban los cristales de
apatita están en baja concentración en la superficie, y alta hacia el limite
amelodentinario, y que son mucho más solubles que los de hidroxiapatita,
comprobándose que son aquellos que se disuelven en los procesos cariosos.
4. Proteínas de la saliva
También
son importantes las proteínas de la placa que se encuentran en contacto con la
superficie del esmalte, ya que es la capa en más directa relación con la zona
superficial del esmalte, y es ella la principal responsable de lo que ocurre en
el esmalte. Esta presenta una barrera semipermeable bastante importante en la
desmineralización y remineralización del esmalte.

Fig.2. Cuadro con las principales funciones
de la saliva, que son importantes porque estas proteínas de la saliva son las
que van a formar la placa bacteriana. (Caries
Res (2004), 38:247)
Dentro
de las funciones de la saliva, hay que destacar las que tienen que ver con los
procesos de remineralización y con las inhibidoras de la desmineralización.
También son importantes aquellas antibacterianas, antifungicas y antivirales,
ya que son estos microorganismos los que durante su metabolismo van a generar
gran parte del ácido que va a estar en contacto con el esmalte.
Dentro
de las antibacterianas, las inmunoglobulinas previenen la adhesión de las
bacterias al esmalte. Las mucinas inhiben la desmineralización, las proteínas
ricas en prolina, el fosfato de calcio, importante en la remineralización,
etc. Estas y otras proteínas del esmalte
se verán en el cuadro a continuación.
En la
medida en que tengamos proteínas que sean capaces de captar distintos iones y
mantenerlos en el esmalte, vamos a estar favoreciendo la remineralización del
esmalte.

Fig.3. Tabla de las concentraciones relativas
de algunas proteínas en
Existe
un estudio reciente, hecho el año 2006, donde a través de mediciones por
electroforesis (bidimensional), se separan las proteínas por distintas
características, en este caso, por peso molecular y punto isoeléctrico (fig.4).
En este estudio se tomaron tres tipos de muestras. La primera era una muestra
de saliva completa para comparar si hay diferencia respecto a la
susceptibilidad a la caries, en personas libres de caries y en personas
susceptibles a caries.

Fig.4. Electroforesis bidimensional.
(Eur J Oral Sci (2006), 114:147)
El
resultado de esta muestra dio que no hay grandes diferencias significativas en
la composición de las proteínas de la saliva. La segunda muestra fue de la
placa bacteriana de los dos grupos en cuestión, cuya extracción se realizo con
un compuesto llamado guanidina, por eso el nombre HAPG, donde se saca casi toda
la película en contacto con el esmalte. Los resultados tampoco arrojaron cifras
significativas, aunque la diferencia era mayor que en el anterior. Luego se
hizo una segunda extracción de la placa bacteriana pero esta vez utilizando un
compuesto llamado Ácido Trifluoracetico, el cual es muy fuerte, y desprendió
toda la placa bacteriana incluyendo aquella más fuertemente adherida al
esmalte. Aquí es donde se encontraron las grandes diferencias entre los
pacientes libres de caries y los susceptibles a caries, ya que en estos últimos
aquellas proteínas que son las primeras en formar la placa, es decir, aquellas
que se unen mas íntimamente con los cristales de hidroxiapatita, se encontraron
Igs, lactoferrinas y amilasas. En aquellas personas que no presentan caries se
encuentran más abundantemente proteínas ricas en prolina, catesinas,
cistatinas, lipocalinas,etc. En general son proteínas que poseen carga
negativa, por ende que se fosforilan y se unen firmemente al cristal que
también tiene fosfato y calcio, y esta fuerte unión es necesaria para el
proceso de remineralización del esmalte. Al ser proteínas cargadas impiden el
movimiento de iones hacia la saliva de lo que se esta desmineralizando, manteniendo
una alta concentración de iones en el esmalte.

Fig.5. Resultados del estudio hecho con
electroforesis bidimensional. Las proteínas subrayadas con rojo son las que se
encontraron presentes en las personas libres de caries (CF) (Eur J Oral Sci (2006),
114:147)
Retroalimentación:
1.-
Nombre las zonas de la lesión de la caries:
2.- ¿Por
qué son importantes las proteínas de la saliva en los procesos de
remineralización y desmineralización de esmalte?
Referencias Bibliográficas:
1.
Montoya M. Clases teóricas. Curso Çariología 2008, Fac.
Odontología, U. Mayor.
2. C.Robinson,
3. J.M. Ten Cate. In situ models, Physico-chemical aspects. Adv
Dent Res 8(2): 125-133, July, 1994.
4.
Markku Larmas. Odontoblast function seen
as the response of dentinal tissue to dental caries. Adv. Dent. Res. 15:68-71,
August, 2001.
![]()